
9.(09北京卷6)下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:
D.工业上电解饱和和食盐水的阳极反应:
答案:A
8. (09广东化学
(09广东化学 14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
 A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4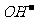
 B.以NaOH溶液为电解液时,负极反应为:Al+3
B.以NaOH溶液为电解液时,负极反应为:Al+3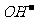 -3e-=Al(OH)3↓
-3e-=Al(OH)3↓
 C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
 D.电池工作时,电子通过外电路从正极流向负极
D.电池工作时,电子通过外电路从正极流向负极
 答案:A
答案:A
 解析: 电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4
解析: 电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4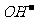 ,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4
,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4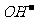 -3e=
-3e= + 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4
+ 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4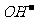 = 4
= 4 + 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错
+ 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错
7. (09广东化学 10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
 A. 锡青铜的熔点比纯铜高
A. 锡青铜的熔点比纯铜高
 B.在自然环境中,锡青铜中的锡对铜起保护作用
B.在自然环境中,锡青铜中的锡对铜起保护作用

 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
 答案:BC
答案:BC
 解析:锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;
解析:锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;
由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;
潮湿的环境将会加快金属的腐蚀速率,C正确;
电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
6. (09福建卷
(09福建卷 11) 控制适合的条件,将反应
11) 控制适合的条件,将反应 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是

A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
答案:D
解析:乙中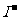 失去电子放电,故为氧化反应,A项正确;
失去电子放电,故为氧化反应,A项正确;
由总反应方程式知,Fe3+被还原成Fe2+,B项正确;
当电流计为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。
加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,而作为负极,D项错。
5.(09广东理科基础 34)下列有关电池的说法不正确的是
34)下列有关电池的说法不正确的是
 A.手机上用的锂离子电池属于二次电池
A.手机上用的锂离子电池属于二次电池
 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极

 C.甲醇燃料电池可把化学能转化为电能
C.甲醇燃料电池可把化学能转化为电能
 D.锌锰干电池中,锌电极是负极
D.锌锰干电池中,锌电极是负极
 答案:B
答案:B
 解析:锂离子电池可以充用,再次使用,属于二次电池,A项正确;
解析:锂离子电池可以充用,再次使用,属于二次电池,A项正确;
铜锌原电池中铜为正极,故电流为铜流向锌,而电子是由锌流向铜,B项错;
电池的实质即是化学能转化成电能,C项正确;
Zn失去电子生成Zn2+,故作为负极,D项正确
4.(09浙江卷 12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li
12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为:
 Li+2Li
Li+2Li
 下列说法不正确的是
下列说法不正确的是
 A.放电时,负极的电极反应式:Li-e
A.放电时,负极的电极反应式:Li-e =Li
=Li
 B.充电时,Li
B.充电时,Li 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
 C.该电池不能用水溶液作为电解质
C.该电池不能用水溶液作为电解质
 D.放电过程中Li
D.放电过程中Li 向负极移动
向负极移动

 答案:D
答案:D
3.(09江苏卷 12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
 A.该电池能够在高温下工作
A.该电池能够在高温下工作
 B.电池的负极反应为:
B.电池的负极反应为:

 C.放电过程中,
C.放电过程中, 从正极区向负极区迁移
从正极区向负极区迁移
 D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下 气体
气体
 答案:B
答案:B

 解析:
解析:
A项,高温条件下微生物会变性,所以A错;
B项,负极是葡萄糖失电子生成二氧化碳,所以B对;
C项,原电池内部阳离子应向正极移动,所以C错;
D项,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,D错
2.(09安徽卷12) Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是
。下列说法正确的是


 A.石墨电极上产生氢气
A.石墨电极上产生氢气
 B.铜电极发生还原反应
B.铜电极发生还原反应
 C.铜电极接直流电源的负极
C.铜电极接直流电源的负极
 D.当有0.1mol电子转移时,有0.1molCu2O生成。
D.当有0.1mol电子转移时,有0.1molCu2O生成。
 答案:A
答案:A
 解析:由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2
解析:由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2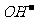 -2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
-2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
1.(09广东理科基础 25)钢铁生锈过程发生如下反应:
25)钢铁生锈过程发生如下反应:
 ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2;
 ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
 ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。
 下列说法正确的是
下列说法正确的是
 A.反应①、②中电子转移数目相等
A.反应①、②中电子转移数目相等
 B.反应①中氧化剂是氧气和水
B.反应①中氧化剂是氧气和水
 C.与铜质水龙头连接处的钢质水管不易发生腐蚀
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
 D.钢铁在潮湿的空气中不能发生电化学腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
 答案:A
答案:A

 解析:①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。
解析:①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。
2.金属的防护方法:①改变金属的内部组织结构。合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。如:不锈钢。②在金属表面覆盖保护层。常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
 ③电化学保护法:外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极。
③电化学保护法:外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极。


击破考点一:考查原电池的基本概念
例1:在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42 -离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
答案:D
[变式训练1]某原电池总反应的离子方程式为: ,不能实现该反应的电池是( )
,不能实现该反应的电池是( )
 A.正极为Cu,负极为Fe,电解质为FeCl3溶液
A.正极为Cu,负极为Fe,电解质为FeCl3溶液
B.正极为Cu,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Cu,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
答案:C
[变式训练2](2007年高考广东化学卷)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为 ( )
A. B.
B.
C. D.
D.
答案:C
击破考点二:电极反应和总反应的书写,常见化学电源
例2:镍氢电池是近年来开发出来的可充电电池,它可以取代会产生污染镉的镍镉电池,镍氢电池的总反应是: H2 + 2NiO(OH)=2Ni(OH)2,根据此反应式判断,下列叙述中正确的是 ( )
A.电池放电时, 电池负极周围溶液的PH值不断增大
B.电池放电时, 镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
答案:CD
[变式训练3]碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液, 电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为: 2MnO2 + H2O(l) +2e- = Mn2O3(s) + 2OH-(aq)
C.电池工作时, 电子由正极通过外电路流向负极
 D. 外电路中每通过度0.2mol电子,锌的质量理论上减小6.5g
D. 外电路中每通过度0.2mol电子,锌的质量理论上减小6.5g
答案:C
[变式训练4](1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:_____________________________________;
银片上发生的电极反应:______________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
 ①产生氢气的体积(标准状况);
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA = 6.02×1023 /mol,电子电荷为1.60×10-19 C)
答案:(1)Zn-2e- = Zn2+; 2H++2e- = H2↑。(2)①锌片与银片减轻,是因与酸反应:
Zn+2H+ = Zn2++H2↑ - 转移2e-
 =
=  =
=
得V(H2) = 4.5 L; Q = 3.8×104 C
击破考点三:电解原理(能量转化,电极反应,活泼电极,惰性电极,浓度变化,恢复,PH变化等。)
例3:如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
答案:A
[变式训练5](2007年高考广东化学卷)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成 ,把二价镍氧化为三价镍。以下说法正确的是( )
,把二价镍氧化为三价镍。以下说法正确的是( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2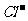 -2e-=Cl2
-2e-=Cl2
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子。
答案:CD
[变式训练6](2007年高考江苏卷)某同学按图所示的装置进行电解实验。下列说法正确
的是( )
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出

 D.整个电解过程中,H+的浓度不断增大
D.整个电解过程中,H+的浓度不断增大
答案:BC
击破考点四:电解的有关计算(电解液浓度,电解后的PH,两极产物)
 例4:某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3︰1,用石墨电极电解该混合液。下列叙述不正确的是
例4:某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3︰1,用石墨电极电解该混合液。下列叙述不正确的是
A.阴极自始至终均析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
答案:D
[解析]电解质溶液中n(Na+):n(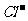 ):n(H+):n(
):n(H+):n(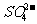 )=3:3:2:1,电解过程明显分为三个阶段:
)=3:3:2:1,电解过程明显分为三个阶段:
第一阶段相当于电解盐酸:
第二阶段相当于电解氯化钠溶液:
第三阶段相当于电解水:
可见只有D不正确。
[变式训练7]在100mlH2SO4与CuSO4的混合液中,用石墨作电极电解一段时间,两极上均收集到2.24L气体(标准状况),则原溶液中Cu2+物质的量浓度为 ( )
A.1molL-1 B.2molL-1 C.3molL-1 D.4molL-1
答案:A
[变式训练8]蓄电池反应如下:负极:Pb+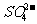 =PbSO4+2e-正极:PbO2+4H++
=PbSO4+2e-正极:PbO2+4H++ 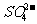 +2e=PbSO4+2H2O若用其电解饱和食盐水制Cl20.05mol电池内消耗H2SO4至少是
( )
+2e=PbSO4+2H2O若用其电解饱和食盐水制Cl20.05mol电池内消耗H2SO4至少是
( )
A. 0.025mol B. 0.05mol C. 0.1mol D. 0.2mol
答案:C
击破考点五:电解的运用(氯碱工业,电解精炼铜,电镀等)
例5:下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶液铜的质量比阴极析出铜的质量小
答案:D
[变式训练9]下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
答案:A
 [变式训练10](2007理综山东,电解饱和食盐水)工业上对海水资源综合开发利用的部分工艺流程如下图所示。
[变式训练10](2007理综山东,电解饱和食盐水)工业上对海水资源综合开发利用的部分工艺流程如下图所示。

(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是________。电解槽中的阳极材料为__________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备?_____原因是 。
(3)溴单质在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是______________________________________。
答案:(1)阴离子(Na+);钛(或石墨)。 (2)否。如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
 (3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重
(3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重
击破考点六:金属腐蚀原理
例6.下列关于金属腐蚀的叙述正确的是 ( )
A.金属在潮湿情况下的腐蚀实质是M+nH2O====M(OH)n+ H2↑
H2↑
B.金属的化学腐蚀实质是M-ne- Mn+,电子直接转移给氧化剂
Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
答案:BD
解析:A项金属在潮湿情况下有可能进行析氢腐蚀,也有可能进行吸氧腐蚀,题目只给出了析氢腐蚀实质。C项中,金属铝的化学腐蚀可以在碱性条件下进行,故此选项错。
[变式训练11]下列叙述不正确的是 ( )
A.金属的电化学腐蚀比化学腐蚀更普通 B.钢铁在干燥空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铝铆钉易被腐蚀 D.原电池中电子由正极流入负极
答案:C
 解析:金属易发生电化学腐蚀,A正确。在干燥空气中钢铁难于形成电化学腐蚀,B正确。铝质铆钉易与铁板形成原电池两极,Fe作负极易发生腐蚀,C不正确。D正确。
解析:金属易发生电化学腐蚀,A正确。在干燥空气中钢铁难于形成电化学腐蚀,B正确。铝质铆钉易与铁板形成原电池两极,Fe作负极易发生腐蚀,C不正确。D正确。
[变式训练12]下列说法正确的是 ( )
 A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的 pH不同,引起的正极反应?不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
答案:CD
解析:金属的腐蚀就是金属失电子而被氧化的过程,因此D是正确的。依据电化学腐蚀中析氢腐蚀和吸氧腐蚀的原理可知,C也是正确的。原电池反应既可以加快金属的腐蚀,也可用以防止金属的腐蚀。例如不锈钢,镀锌铁等中的Fe均不易腐蚀,所以A、B是不正确的
击破考点七:金属腐蚀快慢的比较
例7:取6根铁钉,6支干净的试管及其他材料,准备如下图

试管(1)放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管(2)的试管底放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触。
试管(3)先放入一根铁钉,趁热倒入煮沸的蒸馏水(赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触。
试管(4)中放入铁钉注入食盐水,使铁钉和空气及食盐水接触。
试管(5)放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片。
试管(6)放入相连的铁钉和铜丝,注入自来水浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。其中 试管内的铁钉未被腐蚀。从铁钉被腐蚀的情况可知引起和促进铁钉腐蚀的条件是 。
答案:(2)(3)(5) 水、空气、电解质溶液、不活泼金属杂质的存在
解析:此题实际是利用原电池形成的条件及原理解释金属腐蚀速率问题。由于(2)(3)两个试管不具备构成原电池的条件,不能发生电化学腐蚀,所以暂未被腐蚀。而试管(5)尽管具备构成原电池的条件,但Zn比铁活泼,在原电池中作负极,使铁变成铁离子的反应难以发生,所以铁也暂未被腐蚀。引起和促进铁钉被腐蚀的条件是:水、空气、电解质溶液和不活泼金属杂质的存在。

 [变式训练13]如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
[变式训练13]如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是

A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>① 答案:A
解析: 金属腐蚀的快慢判断方法:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐蚀措施的腐蚀;同一种金属腐蚀:强电解质>弱电解质>非电解质溶液。②、③实质均为原电池装置,④为电解池装置,Fe作阳极,腐蚀最快。③中Fe为正极,被保护;②中Fe为负极,被腐蚀,①中因铁不纯而发生微电池反应。
[变式训练14] 下列几种金属制品的镀层损坏后,金属腐蚀速率最快的是( )
A.镀铝塑料 B.食品罐头盒(镀锡)
C.白铁水桶(镀锌) D.镀银铜质奖章
答案:B
解析:B、C、D选项中的材料在损坏后,均能形成原电池。其中B中Fe作负极,C中Zn作负极,D中Cu作负极,所以B、C中金属腐蚀加快,其中Fe腐蚀更快
击破考点八:金属的防护
例8:为防止海轮船体的腐蚀,应在船体水线以下位置嵌上一定数量的( )
A.铜块 B.铅块
C.锌块 D.钠块
答案:C
解析:海轮船体由钢板焊接而成,为防止浸埋在海水(电解质溶液)中的船体(Fe)的腐蚀,应选用活泼性比铁强,而又不会与水直接反应的金属Zn嵌入船体,这样紧密接触的两种金属接触海水(电解质溶液)时,将发生原电池反应,较活泼的Zn作为原电池的负极,Zn失去电子被氧化,Zn失去的电子流向Fe,从而抑制Fe失去电子被氧化。定期更换嵌入的Zn块,就起到了防止船体被腐蚀的目的。
[变式训练15 ]为保护地下钢管不受腐蚀,可采取的措施有 ( )
A.与石墨棒相连 B.与直流电源负极连接
C.与直流电源正极连接 D.与锌板相连
答案:BD
解析:本题考查金属腐蚀的一种防护方法--电化学保护法。该法的依据一:牺牲阳极的阴极保护法;依据二:外加电流的阴极保护法。

 [变式训练16]下列金属防护的方法不正确的是
( )
[变式训练16]下列金属防护的方法不正确的是
( )
A.对健身器材涂油漆以防止生锈
B.对某些工具的“机械转动部位”选用刷油漆的方法来防锈
C.用牺牲锌块的方法来保护船身
D.自行车的钢圈上镀上一层铬防锈
答案:B
解析:机械转动部位应涂油脂防锈,油脂既防水又能防止气体对金属的腐蚀,还能使转动部位灵活。
击破考点九: 金属腐蚀的电极反应方程式的书写
例9:钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为 ( )
A.Fe-2e- Fe2+
B.2H++2e-
Fe2+
B.2H++2e- H2↑
H2↑
C.
 4
4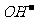 D.Fe-3e-
D.Fe-3e- Fe3+
Fe3+
答案:C
解析:钢铁中含有多种杂质,在考虑钢铁的电化学腐蚀时,为了简化问题,主要讨论碳杂质问题。也就是以Fe为负极,C为正极的原电池反应。在中性条件或弱酸性条件下发生的是吸氧腐蚀。原电池的正极为C,发生的是还原反应,即得电子反应,故A、D选项应排除。在B、C选项中,B项是析氢腐蚀的电极反应式。
[变式训练17]如右图所示,水槽中试管内有一枚铁钉,放置数天后观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,电极反应:负极: ,正极: 。
答案:(1)电化学
(2)弱酸性或中 吸氧 2Fe-4e- 2Fe2+ O2+4e-+2H2O
2Fe2+ O2+4e-+2H2O 4OH-
4OH-
(3)较强的酸 析氢 Fe-2e- Fe2+ 2H++2e-
Fe2+ 2H++2e- H2↑
H2↑

 解析:根据原电池的构成条件,两种不同的材料在有电解质溶液时,若形成闭合回路,即可构成原电池,此时发生的腐蚀属于电化学腐蚀。根据金属腐蚀的条件、原理及结果可知:试管内液面上升,说明试管内压强减小,气体被吸收所致,是铁钉吸氧腐蚀的结果,据此写出电极反应;试管内液面下降,说明试管内气体压强变大,试管内产生了新气体所致,是铁钉的析氢腐蚀的结果,据此写出电极反应。
解析:根据原电池的构成条件,两种不同的材料在有电解质溶液时,若形成闭合回路,即可构成原电池,此时发生的腐蚀属于电化学腐蚀。根据金属腐蚀的条件、原理及结果可知:试管内液面上升,说明试管内压强减小,气体被吸收所致,是铁钉吸氧腐蚀的结果,据此写出电极反应;试管内液面下降,说明试管内气体压强变大,试管内产生了新气体所致,是铁钉的析氢腐蚀的结果,据此写出电极反应。
[变式训练18] 如右图所示,试管中放一铁钉,溶液为氯化钠溶液,数天后观察到的现象有______________。说明铁钉发生了_______________腐蚀,其中正极的电极反应式为__________________,溶液中发生反应的化学方程式为______________

答案:a端液面上升,b端液面下降,铁钉表面有红棕色铁锈生成 吸氧 O2+2H2O+4e-====4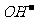 2Fe+O2+2H2O====2Fe(OH)2,4Fe(OH)2+O2+2H2O====4Fe(OH)3
2Fe+O2+2H2O====2Fe(OH)2,4Fe(OH)2+O2+2H2O====4Fe(OH)3
解析:铁钉在NaCl溶液中发生了吸氧腐蚀,使装置中O2减少,气体压强减小,使a端液面上升,b端液面下降。其中Fe作负极,发生反应为:Fe-2e-====Fe2+;正极发生反应为:O2+2H2O+4e-====4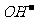 。
。
3

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com