
21、(8分)
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
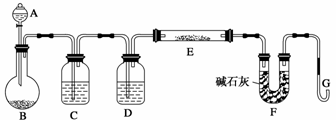
请回答下列问题:
(1)仪器中装入的试剂: C 、D ;
(2)检验该装置气密性的方法是 ;
(3)“加热双通管E”之前,还应进行的操作是 ;
(4)双通管E净重为ag,双通管E加热前质量为bg,充分反应后质量为cg; U型管反应前质量为mg, U型管反应后质量为ng。则W的摩尔质量为 (用字母表示,其它元素的相对原子质量为已知)
20、(6分)
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL。
根据这两种溶液的配制情况回答下列问题:
(1)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH在溶解后未冷却到室温,便注入容量瓶内并定容,则所得溶液浓度 0.1 mol/L。
(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL量筒最好。
配制过程中量取过浓硫酸的量筒,用水洗涤并将洗涤液注入容量瓶内,则所配溶液的物质的量浓度会 (填“偏大” “偏小”“ 无影响”)
19、(9分)
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的物质的量分数为 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,由H2和N2及CO2组成的混合气体,相对于氢气的密度为14。则H2及CO2的体积之比为
(3)在同温、同压下,等质量的O2和O3,所含的分子数之比为 ,所含氧原子数之比为 ,所占的体积之比为 ,气体的密度之比为 。
(4)标准状况下,用排空法收集到的一烧瓶氯化氢气体,将其倒扣在水槽内,充分被水吸收后,气体仍有剩余且占烧瓶容积的1/4。
①则收集到的这瓶气体的平均相对分子质量为
②假设溶液中的溶质全部留在烧瓶内,则所得溶液的物质的量浓度为
18、(10分)
Ⅰ:请填写出:除去下列物质中的杂质的化学药品及除杂方法(括号中的物质为杂质)
(1)苯(苯酚)药品 方法 (2)二氧化碳(氯化氢)药品 方法
(3)二氧化硅(三氧化二铝)药品 方法 (4)乙醇(乙酸)药品 方法
Ⅱ:限用一种药品鉴别下列各组中的物质,请填写对应的药品。
(1)Na2SO4 NH4NO3 KCl(NH4)2SO4 (2)NaOH K2S Na2CO3 Ba(NO3)2
17、(6分)
据下图所示的实验装置回答问题:
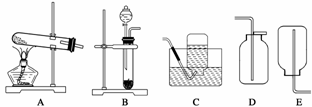
(1)实验室用双氧水制取并收集较纯的氧气时应选用的发生装置是 ,收集装置为 。
(2)实验室用高锰酸钾制取比较干燥的氧气应选用的发生装置是 ,收集装置为 。
(3)实验室用氯化铵与熟石灰两种固体加热制取氨气,氨气的密度比空气的小,极易溶于水。推断:实验室制取氨气应选用的发生装置为 ,收集装置为 。
16、100 g浓度为c mol/L,密度为 p g/cm3的硫酸溶液中,加入一定量的水稀释成0.5c mol/L,则加入水的体积应 ( )
A.小于100 mL B.等于100 mL C.大于100 mL D.等于100/ p mL
第Ⅱ卷
15、有一未知浓度的盐酸溶液25 mL,在加入0.1 mol/LAgNO3溶液25 mL后,改加NaOH溶液,结果用去0.1 mol/L NaOH溶液25 mL恰好完全中和,则此盐酸的物质的量浓度为 ( )
A.0.2 mol/L B.0.5 mol/L C. 0.25 mol/L D. 0.1 mol/L
14、下列说法正确的是 ( )
①标准状况下,22.4 L己烯含有的分子数为6.02×1023
②标准状况下,a L的氧气和氮气的混合物含有的分子数约为 a×6.02×1023
③7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023
④1 mol乙醇中含有的共价键数约为7×6.02×1023
⑤500 mL 1 mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5×6.02×1023
A.①④ B.⑤ C.③④ D.②④
13、NA代表阿伏加德罗常数,下列说法中,不正确的是 ( )
A.标准状况下,NO和O2各11.2 L相混合,所得混合气体的分子总数为小于0.75NA
B.25℃时,1 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
C.1 mol C30H62分子中含有共价键的数目为91NA
D.2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA
12、在200 mL某硫酸盐Rm(SO4)n溶液中,含有1.5 NA个SO42-和NA个R金属离子(NA表示阿伏加德罗常数),则该盐溶液的浓度为 ( )
A. 2 mol/L B.5 mol/L C. 2.5 mol/L D.7.5 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com