
2. 答案:D
答案:D
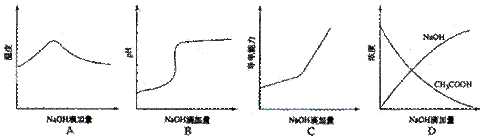
 [详解]A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误。
[详解]A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误。
 [要点1]酸碱中和反应是放热反应。
[要点1]酸碱中和反应是放热反应。
[要点2]醋酸中加入氢氧化钠导电性增强,氨水中加入强酸导电性增强,硫酸中滴入氢氧化钡溶液导电性逐渐减弱,到最弱后,再逐渐增强。
[要点3]强碱弱酸盐溶液中一定有弱酸分子存在,强酸弱碱盐溶液中也一定有弱碱存在,只不过量少而已。
1.答案:B
详解:0.1mo1/L某一元酸HA在水中有0.1%发生电离,说明HA是弱酸,其电离方程式为HA H+
+A- ;
H+
+A- ;
c(H+)=c(HA)·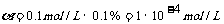 ,pH=-lg{c(H+)}=4,A不符合题意;HA是弱酸,弱酸的电离是吸热的,升温促进电离,电离度
,pH=-lg{c(H+)}=4,A不符合题意;HA是弱酸,弱酸的电离是吸热的,升温促进电离,电离度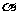 增大,c(H+)随之增大,lg{c(H+)}也增大,-lg{c(H+)}减小,pH减小,B符合题意;电离平衡时c(A-)=
c(H+)=
增大,c(H+)随之增大,lg{c(H+)}也增大,-lg{c(H+)}减小,pH减小,B符合题意;电离平衡时c(A-)=
c(H+)=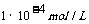 ,c(HA)=0.1mol/L-
,c(HA)=0.1mol/L-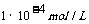 ≈0.1mol/L;
≈0.1mol/L;
此酸的电离平衡常数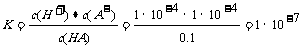 ,C不符合题意;酸的存在抑制了水的电离,使得水电离出来的c(H+)=c(OH-)远小于1
,C不符合题意;酸的存在抑制了水的电离,使得水电离出来的c(H+)=c(OH-)远小于1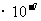 mol/L,酸电离出来的c(H+)=
mol/L,酸电离出来的c(H+)=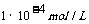 远大于水电里出来的c(H+),溶液中的c(H+)可以忽略水电离出来的c(H+);溶液中的c(H+)=
远大于水电里出来的c(H+),溶液中的c(H+)可以忽略水电离出来的c(H+);溶液中的c(H+)=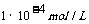 ,
,
 ,水电离出来的c(H+)=c(OH-)=1
,水电离出来的c(H+)=c(OH-)=1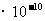 ,由HA电离出的c(H+)约为水电离出的c(H+)的106倍,D不符合题意。
,由HA电离出的c(H+)约为水电离出的c(H+)的106倍,D不符合题意。
要点1:一元弱酸的电离方程式为HA H+
+A- ;溶液中的c(H+)=c(HA)·
H+
+A- ;溶液中的c(H+)=c(HA)·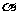 ;溶液的pH= - lg {c(H+)}
;溶液的pH= - lg {c(H+)}
要点2:一元弱酸的电离方程式为HA H+
+A-,此酸的电离平衡常数
H+
+A-,此酸的电离平衡常数
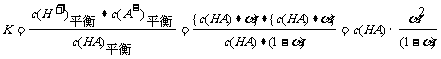
 要点3:一元弱酸的电离方程式为HA
要点3:一元弱酸的电离方程式为HA H+
+A-,由HA电离出的c(H+)约为水电离出的c(H+)的倍数关系:
H+
+A-,由HA电离出的c(H+)约为水电离出的c(H+)的倍数关系: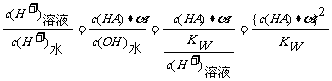 2
2 。(宁夏理综卷第11题)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
。(宁夏理综卷第11题)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是

1.(海南化学卷第6题,3分)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4 B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
8. 已知函数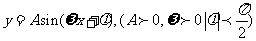 的图象在y轴右侧的第一个最高点为
的图象在y轴右侧的第一个最高点为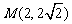 ,与x轴在原点右侧的第一个交点
,与x轴在原点右侧的第一个交点 ,求这个函数的解析式。
,求这个函数的解析式。
7.若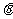 为锐角,且
为锐角,且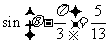 ,则
,则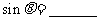
6.等腰三角形底角的正弦与余弦的和为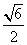 ,则顶角的弧度数为
,则顶角的弧度数为
5.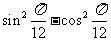 的值为
的值为

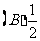
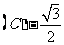
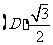
4.将函数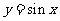 的图象上每点的横坐标缩小为原来的
的图象上每点的横坐标缩小为原来的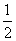 (纵坐标不变),再把所得图象向左平移
(纵坐标不变),再把所得图象向左平移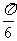 个单位,得到的函数解析式为
个单位,得到的函数解析式为
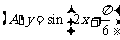
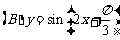
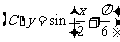
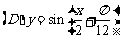
3.函数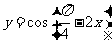 在下列区间上为增函数的是
在下列区间上为增函数的是
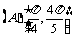
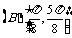
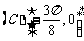

2.下列函数中周期为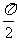 的奇函数是
的奇函数是
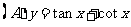
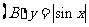
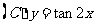
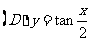
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com