
7.答案:C
解析:根据以下反应得出酸性由强到弱的顺序:
CH3COOH>H2CO3 :2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2 ↑
H2CO3>C6H5OH :C6H5ONa+H2O+CO2 →C6H5OH+NaHCO3
根据以下反应得出碱性强弱顺序:Na2CO3>C6H5ONa :C6H5OH+Na2CO3 →C6H5ONa+NaHCO3
C6H5ONa> NaHCO3 :C6H5ONa+H2O+CO2 →C6H5OH+NaHCO3
溶液酸性越强,pH越小;溶液水解碱性越强,pH越大,按溶液pH由小到大排列正确的是①④②⑥③⑤。
7.(全国II卷理综第10题,6分)现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。按溶液pH由小到大排列正确的是
A.④①②⑤⑥③ B.④①②⑥⑤③ C.①④②⑥③⑤ D.①④②③⑥⑤
6.答案:C
解析:滴定过程中始终存在电荷守恒:c(Cl-)+c(OH-)=c(H+)+
c(NH ),也存在:c(Cl-)- c(NH
),也存在:c(Cl-)- c(NH )= c(H+)- c(OH-)
)= c(H+)- c(OH-)
当c(Cl-)- c(NH )= c(H+)- c(OH-)>0溶液呈酸性时,c(Cl-)>c(NH
)= c(H+)- c(OH-)>0溶液呈酸性时,c(Cl-)>c(NH ), c(H+)>c(OH-)出现D选项的情形。
), c(H+)>c(OH-)出现D选项的情形。
当c(Cl-)- c(NH )= c(H+)- c(OH-)=0溶液呈中性时,c(Cl-)=c(NH
)= c(H+)- c(OH-)=0溶液呈中性时,c(Cl-)=c(NH ), c(H+)=c(OH-)出现B选项的情形。
), c(H+)=c(OH-)出现B选项的情形。
当c(Cl-)- c(NH )= c(H+)- c(OH-)<0溶液呈碱性时,c(Cl-)<c(NH
)= c(H+)- c(OH-)<0溶液呈碱性时,c(Cl-)<c(NH ), c(H+)<c(OH-)出现A选项的情形。
), c(H+)<c(OH-)出现A选项的情形。
无论何时都不会出现C选项的情形。
要点:滴定过程中先后出现的几种可能的离子浓度关系:
①.溶液呈酸性时,溶质有三种可能:盐酸和氯化铵、氯化铵、氯化铵和氨水;离子浓度有三种情形:c(Cl-)>c(H+)>c(NH )>c(OH-)、c(Cl-)>
c(H+) = c(NH
)>c(OH-)、c(Cl-)>
c(H+) = c(NH ) >c(OH-)、c(Cl-)>c(NH
) >c(OH-)、c(Cl-)>c(NH )>c(H+)>c(OH-) 。
)>c(H+)>c(OH-) 。
②.溶液呈中性时,溶质只有一种可能:氯化铵和氨水;离子浓度有一种情形:c(Cl-)
= c(NH ) >c(H+) =c(OH-) 。
) >c(H+) =c(OH-) 。
③.溶液呈碱性时,溶质只有一种可能:氯化铵和氨水;离子浓度有三种情形。c(NH ) >c(Cl-) > c(OH-) > c(H+), c(NH
) >c(Cl-) > c(OH-) > c(H+), c(NH ) >c(Cl-) = c(OH-)> c(H+)
;c(NH
) >c(Cl-) = c(OH-)> c(H+)
;c(NH ) >c(OH-)> c(Cl-) > c(H+)。
) >c(OH-)> c(Cl-) > c(H+)。
6.(全国I理综第10题,6分)用0.10
mol·L 的盐酸滴定0.10 mol·L
的盐酸滴定0.10 mol·L 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.c(NH ) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH
) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH ) = c(Cl-) ,c(OH-)
= c(H+)。
) = c(Cl-) ,c(OH-)
= c(H+)。
C.c(Cl-)>c(NH ) ,c(OH-) > c(H+) D. c(Cl-)>c(NH
) ,c(OH-) > c(H+) D. c(Cl-)>c(NH ) ,c(H+)>c(OH-)
) ,c(H+)>c(OH-)
5. 答案B
答案B
 详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH
详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH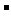 )+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
)+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
 要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点2:相同温度下,同浓度同元数的强酸溶液比弱酸溶液更能抑制水的电离,强酸溶液中水电离出来的氢离子浓度更小。
要点3:氯化铵溶液中的三守恒一大小关系:
(1)溶质守恒:c(Cl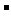 )=
c(NH
)=
c(NH )+ c(NH3·H2O)
)+ c(NH3·H2O)
(2)溶剂守恒:c(H+)=c(OH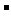 )+c(NH3·H2O)
)+c(NH3·H2O)
(3)电荷守恒:c(NH ) +c(H+)=c(Cl
) +c(H+)=c(Cl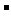 )+c(OH
)+c(OH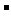 )
)
(4)大小关系:c(Cl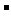 )>c(NH
)>c(NH )>c(H+)>c(OH
)>c(H+)>c(OH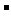 )
)
-----------------------------------------------------------------------------------------------------------------------------------------
5. (四川理综卷第12题)关于浓度均为0.1
mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
(四川理综卷第12题)关于浓度均为0.1
mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是

 A. c(NH
A. c(NH ):③>①
):③>①
 B.水电离出的c(H+):②>①
B.水电离出的c(H+):②>①
 C.①和②等体积混合后的溶液:c(H+)=c(OH
C.①和②等体积混合后的溶液:c(H+)=c(OH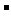 )+c(NH3·H2O)
)+c(NH3·H2O)
 D.①和③等体积混合后的溶液:c(NH
D.①和③等体积混合后的溶液:c(NH )>c(Cl
)>c(Cl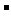 )>c(OH
)>c(OH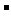 )>c(H+)
)>c(H+)
4.答案:A
详解:由表中数据可知,H2CO3的酸性大于HClO,HClO的酸性大于HCO3-的酸性,则ClO-的水解程度大于HCO3-,c(HCO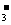 )>c(ClO-),溶质离子浓度大于溶剂离子浓度,NaClO、NaHCO3溶液水解呈碱性c(HCO
)>c(ClO-),溶质离子浓度大于溶剂离子浓度,NaClO、NaHCO3溶液水解呈碱性c(HCO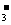 )>c(ClO-)>c(OH-)>c(H+)故A项正确, B项错误。根据物料守恒:c(HClO)+c(ClO-)=
c(HCO
)>c(ClO-)>c(OH-)>c(H+)故A项正确, B项错误。根据物料守恒:c(HClO)+c(ClO-)=
c(HCO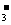 )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO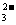 ),C错误;根据电荷守恒:c(Na+)+c(H+)=
c(HCO
),C错误;根据电荷守恒:c(Na+)+c(H+)=
c(HCO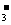 )+c(ClO-)+c(OH-)+2 c(CO
)+c(ClO-)+c(OH-)+2 c(CO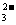 )
)
D选项错误。
4.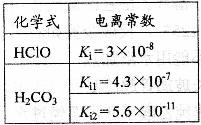
 (上海化学卷第17题)根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
(上海化学卷第17题)根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
 A.c(HCO
A.c(HCO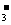 )>c(ClO-)>c(OH-)
)>c(ClO-)>c(OH-)
 B.c(ClO-)>c(HCO
B.c(ClO-)>c(HCO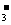 )>c(H+)
)>c(H+)
 C.c(HClO)+c(ClO-)=
c(HCO
C.c(HClO)+c(ClO-)=
c(HCO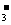 )+c(H2CO3)
)+c(H2CO3)
 D.c(Na+)+c(H+)=
c(HCO
D.c(Na+)+c(H+)=
c(HCO )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)
3.答案:B
详解:A项中由于两种酸的浓度不知,无法比较pH大小,故错误。C项没有限定是饱和溶液,C项也错误。单质还原性强弱与失电子难易有关,与数目没有必然关系, 故D错误。
3. (上海化学卷第14题)根据以下事实得出的判断一定正确的是
(上海化学卷第14题)根据以下事实得出的判断一定正确的是

 A.HA的酸性比HB的强,则HA溶液 pH比HB溶液的小
A.HA的酸性比HB的强,则HA溶液 pH比HB溶液的小
 B.
B. 和
和 的电子层结构相同,则A原子的核电荷数比B原子的大
的电子层结构相同,则A原子的核电荷数比B原子的大
 C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com