
12. 答案:C
解析:溶液由溶质和溶剂组成,NaHCO3溶液中存在溶剂水的电离平衡(H2O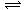 H+
+OH-)和溶质阴离子HCO
H+
+OH-)和溶质阴离子HCO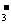 的电离平衡(HCO
的电离平衡(HCO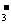
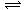 H+
+CO
H+
+CO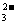 ),Na2CO3溶液中只存在溶剂水的电离平衡,NaHCO3和Na2CO3溶液都是强碱弱酸盐,都可以发生水解,存在水解平衡(HCO
),Na2CO3溶液中只存在溶剂水的电离平衡,NaHCO3和Na2CO3溶液都是强碱弱酸盐,都可以发生水解,存在水解平衡(HCO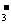 +H2O
+H2O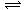 H2CO3+OH-
,CO
H2CO3+OH-
,CO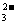 +H2O
+H2O HCO
HCO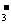 +OH-),其中Na2CO3包括两个水解平衡,A正确不符合题意;根据前面分析的电离平衡和水解平衡,得知NaHCO3和Na2CO3溶液中存在共同的微粒成分:2种分子:H2O
、H2CO3 ,5种离子:Na+
、HCO
+OH-),其中Na2CO3包括两个水解平衡,A正确不符合题意;根据前面分析的电离平衡和水解平衡,得知NaHCO3和Na2CO3溶液中存在共同的微粒成分:2种分子:H2O
、H2CO3 ,5种离子:Na+
、HCO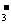 、CO
、CO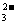 、OH-、H+
B正确不符合题意;同浓度时CO
、OH-、H+
B正确不符合题意;同浓度时CO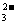 水解程度比HCO
水解程度比HCO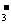 强,Na2CO3溶液的碱性比同浓度的NaHCO3溶液的碱性强,即NaHCO3和Na2CO3溶液中c(OH-)前者小于后者,C错误符合题意;分别加入NaOH固体,NaHCO3和NaOH发生中和反应,c(CO
强,Na2CO3溶液的碱性比同浓度的NaHCO3溶液的碱性强,即NaHCO3和Na2CO3溶液中c(OH-)前者小于后者,C错误符合题意;分别加入NaOH固体,NaHCO3和NaOH发生中和反应,c(CO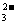 )增大,Na2CO3溶液中加入NaOH固体抑制碳酸钠水解,c(CO
)增大,Na2CO3溶液中加入NaOH固体抑制碳酸钠水解,c(CO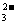 )增大 ,当然分别加入NaOH固体,NaOH固体溶于水放热,能促进水解,使c(CO
)增大 ,当然分别加入NaOH固体,NaOH固体溶于水放热,能促进水解,使c(CO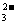 )都减小,但是恢复到原温度,这种温度因素消失,溶液中的氢氧根离子的作用不会因温度的降低而消失,最终c(CO
)都减小,但是恢复到原温度,这种温度因素消失,溶液中的氢氧根离子的作用不会因温度的降低而消失,最终c(CO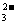 )都增大 ,D正确不符合题意。
)都增大 ,D正确不符合题意。
要点:①溶液中的电离平衡和水解平衡的分析;②根据溶液中的电离平衡和水解平衡分析溶液中存在哪些分子和哪些离子(溶液中的粒子种类分析);③比较同浓度溶液水解或电离以后溶液的酸碱性强弱 ;④外界条件(温度、浓度、压强等)对水解平衡和电离平衡的影响。
12.(天津理综第2题,6分)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡 B.存在的粒子种类相同
C.c(OH-)前者大于后者 D.分别加入NaOH固体,恢复到原温度,c(CO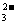 )均增大
)均增大
11.答案:AB
详解:硝酸为强电解质,完全电离,硝酸溶液的浓度等于硝酸溶液的c(H+),pH为1的硝酸溶液c(H+)=c(HNO3)=0.1mol·L-1,根据稀释定律,C1V1=C2V2
,0.1×1=C2×100,C2=0.001,pH=3,A项正确。pH为13的氢氧化钡溶液中c(H+)=1×10-13mol·L-1,c(OH-)= ,B选项正确。硝酸电离出的c(H+)为0.1 mol/l,硝酸溶液中的c(OH-)=
,B选项正确。硝酸电离出的c(H+)为0.1 mol/l,硝酸溶液中的c(OH-)=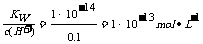 ,硝酸溶液中水电离出来的c(OH-)与水电离出的c(H+)相等为10-13 mol/L,该溶液中硝酸电离出的
,硝酸溶液中水电离出来的c(OH-)与水电离出的c(H+)相等为10-13 mol/L,该溶液中硝酸电离出的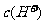 与水电离出的
与水电离出的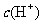 之比值为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D选项错误。
之比值为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D选项错误。
要点1:pH=a的强酸溶液稀释10n倍,稀释后溶液的pH=a+n≤7, pH=a的弱酸溶液稀释10n倍,稀释后溶液的pH<a+n≤7;pH=b的强碱溶液稀释10n倍,稀释后溶液的pH=b-n≥7, pH=b的弱碱溶液稀释10n倍,稀释后溶液的pH>b-n≥7。
要点2:强酸溶液中c(H+)远大于水电离出来的c(H+)水 ,强酸溶液中OH-是溶剂水电离出来的,溶剂水电离出来的c(H+)水=c(OH-), c(H+)水=c(OH-)=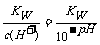 ;强碱溶液中c(OH-)远大于水电离出来的
;强碱溶液中c(OH-)远大于水电离出来的
c(OH-)水 ,强碱溶液中H+是溶剂水电离出来的,溶剂水电离出来的c(OH-)水=c(H+), c(OH-)水=c(H+)=10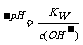 ;
;
-----------------------------------------------------------------------------------------------------------------------------------------
11.(上海化学卷第20题,3分) 对于常温下pH为1的硝酸溶液,下列叙述正确的是
对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的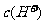 与水电离出的
与水电离出的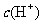 之比值为
之比值为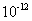 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的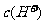 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的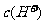 的100倍
的100倍
10.答案:B
详解:Ba(OH)2 (强碱)、Na2SO3(水解呈碱性) 、FeCl3 (水解呈酸性)、KCl(不水解呈中性),A错误;Na2SiO3(水解呈碱性) 、Na2CO3 (水解呈碱性)、KNO3(不水解呈中性) 、NH4Cl(水解呈酸性),硅酸的酸性比碳酸弱(非金属性越强最高价氧化物对应的水化物的酸性越强,同族元素原子序数越小非金属性越强),Na2SiO3的碱性比Na2CO3碱性强,B正确;NH3 ·H2O(电离呈碱性) 、H3PO4(电离呈酸性、中强酸) 、Na2SO4 (不水解呈中性)、H2SO4 (电离呈酸性、二元强酸) ,C错误;NaHCO3 (水解呈碱性) 、C6H5COOH(有机一元弱酸) 、C2H5OH (中性)、HCl(一元强酸),D错误。
要点:物质的量浓度相同的下列溶液,pH由大到下排列的是:
二元强碱、一元强碱、一元弱碱(或强碱弱酸盐)、强酸强碱盐(醋酸铵)、一元弱酸(强酸弱碱盐)、一元强酸、二元强酸
10.(重庆理综第10题,6分)物质的量浓度相同的下列溶液,pH由大到下排列正确的是
A.Ba(OH)2 、Na2SO3 、FeCl3 、KCl B.Na2SiO3 、Na2CO3 、KNO3 、NH4Cl
C.NH3 ·H2O 、H3PO4 、Na2SO4 、H2SO4 D.NaHCO3 、C6H5COOH 、C2H5OH 、HCl
9.答案:D
解析:根据电荷守恒,离子浓度最大的和最小的带同种电性,A错误;Na2CO3溶液加水稀释后,虽然稀释促进了碳酸钠的水解,氢氧根离子的绝对数量有所增加,但是由于稀释的对溶液浓度的影响远大于平衡移动的影响,碳酸钠溶液中的氢氧根浓度减小符合题意,但是Kw是温度的函数,温度不变,Kw不变,B错误;pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,溶液中的c(H+)相等,水电离出来的c(H+)不等,pH=5的CH3COOH溶液中水电离出来的氢离子浓度等于水电离出来的氢氧根浓度,溶质电离出来的氢离子浓度c(H+)=10-5mol/L,KW=1×0-14
,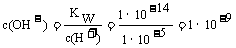 ,
,
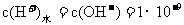 ,pH=5的NH4Cl溶液中,由于铵根离子结合水电离出来的氢氧根离子,促进了水的电离,水电离出来的氢离子浓度就是NH4Cl溶液中的氢离子浓度,c(H+)=1×10-5
,C 错误;在Na2S溶液中加入AgCl固体,发生沉淀的转移生成更难溶的硫化银沉淀:2AgCl+Na2S=Ag2S↓+2NaCl
, 致使溶液中c(S2-)下降,D正确。
,pH=5的NH4Cl溶液中,由于铵根离子结合水电离出来的氢氧根离子,促进了水的电离,水电离出来的氢离子浓度就是NH4Cl溶液中的氢离子浓度,c(H+)=1×10-5
,C 错误;在Na2S溶液中加入AgCl固体,发生沉淀的转移生成更难溶的硫化银沉淀:2AgCl+Na2S=Ag2S↓+2NaCl
, 致使溶液中c(S2-)下降,D正确。
要点:沉淀的转移:在Na2S溶液中加入AgCl(AgBr 、AgI)固体,溶液中c(S2-)都下降,因为Ag2S的溶解度比AgCl(AgBr 、AgI)的溶解度更小。
9.(天津理综第4题,6分)下列叙述正确的是
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
8。 答案:B
答案:B
解析:四种溶液有共同的成分CH3COONa,比较溶液的酸碱性就比较另一种成分即可,0.1mol/L的四种溶液HCl(强酸)、NaOH(强碱)、NaCl(中性盐)、NaHCO3 (强碱弱酸盐)的pH关系:②>④>③>①,A错误;c(H+)关系:①>③>④>②,C错误;CH3COONa水解呈碱性,另一种溶液碱性越强,越抑制醋酸根水解,c(CH3COO-)浓度越大,所以c(CH3COO-)浓度关系和pH关系相同:②>④>③>①,B对;CH3COONa水解呈碱性,另一种溶液酸性越强,越促进醋酸根水解,c(CH3COOH)浓度越大,所以c(CH3COOH)浓度关系和c(H+)关系相同: ①>③>④>②,D错误。
要点1:等浓度溶液pH的大小顺序为:二元强碱、一元强碱、一元弱碱(强碱弱酸盐)、强酸强碱盐、(强酸弱碱盐)一元弱酸、一元强酸、二元强酸。
要点2:CH3COONa水解呈碱性,加热促进水解,c(CH3COO-)减小,c(CH3COOH)增大;通入氯化氢气体,促进水解,c(CH3COO-)减小,c(CH3COOH)增大;加入碱性或水解呈碱性的固体,抑制水解,c(CH3COO-)增大,c(CH3COOH)减小。
8.(北京理综第11题,6分)有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa和HCl;②CH3COONa和NaOH;③CH3COONa和NaCl;④CH3COONa和NaHCO3
;列各项排序正确的是
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>② 学
学
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com