
26.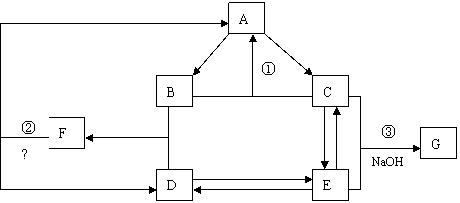 (12分)下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。
(12分)下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。
已知:F可用作氮肥,也可用来制作炸药;G可用作防腐剂或建筑工程上的抗冻剂。根据有关信息回答下列问题:
(1)单质A必定是(填“金属”或“非金属”) ,理由是
。
(2)写出反应①的化学方程式: ,指出该反应在现代生活中的实际意义 。
(3)物质B的分子的空间构型为 。
(4)已知反应②是氧化还原反应,其中氧化产物与还原产物的质量比为 。
(5)写出反应③的离子方程式: 。
25.(10分)白磷(P4)是一种常见的非金属,可用于制备较纯的磷酸。
(1)白磷分子内含有的化学键是 键,它的空间结构是一种正四面体形。它不溶于水而易溶于二硫化碳,说明白磷是 分子(填“极性”或“非极性”)。
(2)已知白磷和氯酸溶液可以发生如下反应:
___P4+__HClO3+__ ________--___HCl + __H3PO4
配平并完成上述反应的化学方程式,该反应的氧化剂是_____________
(3)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4+60CuSO4+96H2O==20Cu3P+24H3PO4+60H2SO4
该反应的氧化产物是____________。若有11molP4反应,则有_______mol电子转移。
24.(7分)某混合气体中可能含有NO、NO2、NH3、HCl、Cl2、N2、O2中的两种或多种,
现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小;当剩余的气体与空气接触,立即变为红棕色,则在原混合气体中,一定不存在的气体是____________,一定存在的气体是___________________,可能存在的气体是___________________。
23.(6分)Na3N是离子化合物,它与水作用可产生氨气,试回答下列问题:
(1)写出Na3N的电子式_____________;
(2)比较Na+与N3-微粒半径大小r (Na+) r (N3-);
(3)写出Na3N与足量盐酸反应的化学方程式 。
22.在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系是( )
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
21.一定量的铜与一定量的浓硝酸完全反应,产生NO、NO2两种气体,已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶3 D.2∶1
20.某白色固体为K2SO4、NH4Cl、AgNO3、K2CO3、NH4NO3五种物质中的两种混合物。取少量该固体放入试管甲中,加水得无色溶液再加入过量BaCl2溶液,生成白色沉淀,过滤后沉淀加稀HNO3沉淀不溶;过滤液中加AgNO3溶液,也生成不溶于HNO3的白色沉淀。另取少量该白色固体加入试管乙中,加NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体。再取少量该固体放入试管丙中,加适量稀HNO3将固体完全溶解,再加入Ba(NO3)2溶液,无沉淀生成。则该白色固体的组成为( )
A.K2SO4、NH4Cl B.NH4Cl、NH4NO3
C.K2CO3、NH4NO3 D.NH4NO3、AgNO3
19.NO2、NH3、O2的混合气体,一定条件下恰好完全反应生成N2和H2O,则原混合气体中NO2、NH3、O2的体积比可以是(不考虑2NO2 N2O4)( )
N2O4)( )
A.2:4:1 B、2:1:2 C、1:2:1 D、1:4:3
18.某金属单质跟一定浓度的HNO3反应,假定只产生单一的还原产物。当参加反应的单质与被还原的HNO3物质的量之比为2:1时,还原产物是( )
A.NO2 B、NO C、N2O D、N2
17.通过实验观察,得知某气体有下列性质:①无色有刺激性气味;②潮湿空气中形成雾;③易溶于水,溶液使石蕊试纸变红;④把它加入浓HNO3中,产生红棕色气体。据此判断该气体可能是( )
A.SO3 B、SO2 C、NO D、HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com