
12.[江苏省赣榆高级中学2009年高考双周模拟试卷 ] (7分)
江苏宝胜集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:

 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生
反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:

(1)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(2)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法:
。
(3)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
答案.(1)乙 。甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。(关键词:“污染空气”)
(2)“确保CuSO4 用完”或“将Cu完全置换出来”,其他类似说法均可。
将所得铜粉酸洗后再洗涤、干燥;或过滤前在加适量的酸以除去剩余的铁粉。
(3)蒸发 、降温 。 水污染或环境污染。
 w.w.w.k.s.5.u. c.o.
w.w.w.k.s.5.u. c.o.
11.[江苏省赣榆高级中学2009年高考双周模拟试卷 ] (10分)
铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ(6分)实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实
验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO
混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收
集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
⑴ 上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为:
。
⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的
量为 mol。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
Ⅱ、 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:

⑴ 请通过计算确定m的值;
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑵ X的摩尔质量为368 g/mol,请确定X的化学式。
答案..Ⅰ⑴不完全,CO,CO2+C高温2CO 或 CuO+C高温Cu+CO↑⑵7.4g, 0.025 mol
Ⅱ、⑴ 解:依题意,m g X中:n(Cu)∶n(Fe)=1∶1
2n(Cu2+) +3n(Fe3+) =6.05mol·L-1×0.2L×2-1 mol·L-1×2.12L
故:n (Cu) = n (Fe) = 0.06mol
又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
因此,m g = m(Cu) + m(Fe) + m(S)
= 0.06mol×64g·mol-1+0.06mol×56g·mol-1+0.12mol×32g·mol-1= 11.04g
即m 的值为11.04 (2分)
⑵ 解:设X的化学式为(CuFeS2)n,则
(64+56+32×2)×n = 368 n = 2故X的化学式为Cu2Fe2S4 (2分)
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
10、 [江苏省启东中学2009届高三第一学期第二次月考 ] (10分) 碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:① 取a g的晶体研成粉末。② 晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。③ 另取a
g的晶体,溶于足量某溶液中充分溶解得到溶液。④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c
g。
[江苏省启东中学2009届高三第一学期第二次月考 ] (10分) 碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:① 取a g的晶体研成粉末。② 晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。③ 另取a
g的晶体,溶于足量某溶液中充分溶解得到溶液。④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c
g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在______ __(填仪器名称)中灼烧,灼烧后得到的固体应为___________(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算X的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c缺一不可
答案..(10分)(1)②③④(2分);(2)坩埚(1分); CuO(1分); (3)HNO3(2分); (4)过滤(1分)、 洗涤(1分); (5)A、B (2分)
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是___________________________。
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:_____________________________________
________________________。
答案..(1)碱性(1分) ClO- + H2O 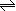 HClO + OH- (2分)
HClO + OH- (2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空1分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (1分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (1分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(2分)
9.[江苏省启东中学2009届高三阶段调研测 ](12分)在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1) 铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实
验装置示意图(铁架台可省略,导气管的形状可根据需要选择)

(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,
过滤。若混合物中既有Fe2+又有Fe3+,则证明该结论的实验方法是:
____________________________________________________________________________
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含十3价
的Fe元素。原因是(结合离子方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种。
__________
答案..(l) 3Fe+4H2O(g)  Fe3O4+4H2↑
Fe3O4+4H2↑
(2)检验是否有H2产生

(4)各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+。
(5)如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色。反应的离子方程式为Fe+2Fe3+=3Fe2+,
(6)①4Fe(OH)2+O2+2H2O==4Fe(OH)3
②第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2-3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量。
该消毒液对碳钢制品是否有腐蚀作用?
18、
(1)由前三列数据可知物体在斜面上匀加速下滑时的加速度为a1==5m/s2,
mg sin a=ma1,可得:a=30°,
(2)由后二列数据可知物体在水平面上匀减速滑行时的加速度大小为a2==2m/s2,
mmg=ma2,可得:m=0.2,
(3)设物体在斜面上下滑的时间为tB,B点的速度为vB则在斜面上a1=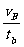
在水平面a2=- 代入数据得tB=0.5s vB=2.5m/s
代入数据得tB=0.5s vB=2.5m/s
t=0.6s时物体在水平面上,其速度为v=vB-a2△t=2.3 m/
17、  方向为水平向左
方向为水平向左
 方向为竖直向上
方向为竖直向上
16、(1) 10m/s;(2) 在5s时停止、25m;(3)略
8、AC 9、D 10、A 11、ABD 12、C
二。13、4,F, 水平向左 14、ACD 15、0.5 0.375
18、(11分)如图所示,物体从光滑斜面上的A点由静止开始下滑,经过B点后进入水平面(设经过B点前后速度大小不变),最后停在C点。每隔0.2秒钟通过速度传感器测量物体的瞬时速度,下表给出了部分测量数据。(重力加速度g=10m/s2)
 求:(1)斜面的倾角a;
求:(1)斜面的倾角a;
(2)物体与水平面之间的动摩擦因数m;
 (3)t=0.6s时的瞬时速度v
(3)t=0.6s时的瞬时速度v
答案:一、1、B 2、C 3、B 4、AC 5、AC 6、AB 7、AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com