
1.A 2.CD 3.C 4.B 5.B 6.C 7.AC 8.C 9.AD 10.C 11.C 12.A
讲析:1.Mg可与NH4Cl溶液反应产生H2 2.反应原理:CaCO3 → CaO → Ca(OH)2 → Mg(OH)2 →MgCl2 → Mg 3.假设样品为纯净物,其物质的量为0.1mol,产生0.2mol的沉淀,小于实际沉淀量,故一定含MgCl2。4.按NaOH的量不同反应原理不同的几种情况来讨论。 5.Al与NaOH溶液反应的本质。8.根据电子得失守恒,产生等量的H2时,n(Fe):n(Si) =2:1,则m(Fe):m(Si) = 4:1
4.(1) 2g (2) 0.6675g (3) 0.95g (4) 90mL
讲析:加入10mLHCl正好中和过量,此时沉淀为Mg(OH)2,
再加HCl沉淀增多,20mL时AlO2-全部转化为Al(OH)3,P点时加入的HCl刚好把Mg(OH)2 、Al(OH)3溶解掉。
检测提高
1.D 2.D 3.AB
讲析:1.既能与强酸反应, 又能与强碱反应的物质一般有:①某些金属Al ②两性氧化物Al2O3 ③两性氢氧化物Al(OH)3 ④多元弱酸的酸式盐如NaHCO3、NaHS、NaHSO3、Na2HPO4、NaH2PO4等 ⑤弱酸的铵盐如: (NH4)2S、(NH4)2CO3、CH3COONH4、(NH4)2SO3⑥氨基酸等。 2.反应后天平是否平衡,决定于产生H2的质量。本题应按照酸是否过量的几种情况来讨论。3.若酸为强酸,选项B符合题意,若酸为弱酸,选项A符合题意。
13.(1)Mg 3.6 Al 2.7(2)1.4mol/L
讲析:oa段中和过量盐酸,ab段产生Al(OH)3和
Mg(OH)2沉淀,bc段Al(OH)3沉淀完全溶解。
第31课时 (B卷)
纠错训练
12. 1L 讲析:沉淀量最大时,n(Na+)=n(Cl-)
11.(1)A.Al B.AlCl3 C.Al(OH)3 D.Al2(SO4)3 E.NaAlO2
(2)
①2Al + 3Cl2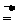 2AlCl3
2AlCl3
②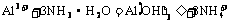
③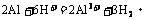
④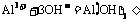
⑤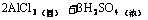

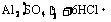
⑥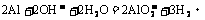
⑦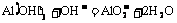
⑧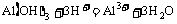
讲析:既能与酸又能与碱反应的金属单质是Al。
10.(1)滴加氨水至过量Al3++3NH3·H2O= Al(OH)3↓+NH4+
(2)通人CO2至过量 AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-
8. Al(OH)3在溶解的过程中质量的减少小于BaSO4沉淀
质量的增大。 9. n(Al3+)=n[Al(OH)3]或n(AlO2-)= n[Al(OH)3]
1.A 2.C 3.C 4.C 5.D 6.C 7.AD 8. C 9. BD
讲析:2.镁能在CO2中燃烧,铝能发生铝热反应,铝在常温时遇浓硝酸钝化。3.除溶液为无色外,本题应按在酸性或碱性条件下两种情况讨论。5.溶质均为MgSO4且量相等,主要运用守恒法比较溶液的质量大小。 6. n(NaOH)=n(Cl-)+n(Al3+) 7.反应后形成NaCl和NaAlO2的混合溶液。
4.⑴中和过量H2SO4 ⑵3.25mol/L ⑶ Al2O3和Fe2O30.05mol
讲析:计算时注意运用电荷守恒。
检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com