
3.  、
、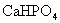 均为难溶于水的白色固体.某同学向
均为难溶于水的白色固体.某同学向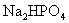 溶液中滴加
溶液中滴加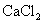 溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是
溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是 还是
还是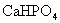 .(已知:
.(已知: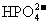 水解程度大于电离程度)
水解程度大于电离程度)
|
实验原理______________________________________________________ 实验用品及试剂:烧杯、玻璃棒、试管、滴管;石蕊试液、酚酞、pH试纸 |
|
实验步骤、现象及结论:(可以不填满) 1.___________________________________________________________ 2.___________________________________________________________ 3.___________________________________________________________ 4.___________________________________________________________ 5.___________________________________________________________ |
1. 某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
 以下是该学习小组部分交流记录及后续探究实验的记录
以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:________ ___ 。
设计实验验证你的猜想________________ 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
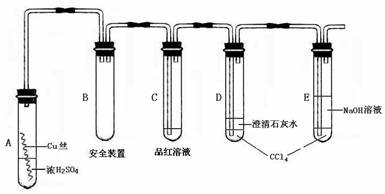
 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5 g |
|
|
⑥ |
1.2 g |
MnO2
0.5 g |
|
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,__________________________________________ ___________________________________ _________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a、_______________________________,b、 。
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
⑵步骤③中洗涤沉淀的操作是______________________________________________
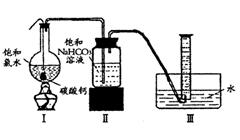 在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。请回答:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,
最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体BL,发现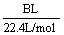 明显小于
明显小于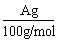 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
;
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是
。
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
量气泡产生,溶液浅黄绿色褪去;
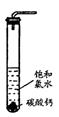 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是___________________________ ;
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
3.已知SiO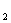 、SO
、SO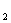 和CO
和CO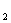 都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
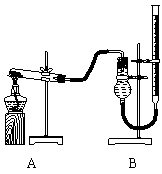
Ⅰ.用如图所示装置进行Mg与SO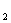 反应的实验。
反应的实验。
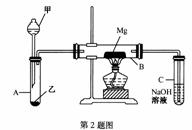 (1)选择制取SO
(1)选择制取SO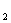 的合适试剂___________
的合适试剂___________
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④ CaSO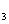 固体
固体
(2)写出装置B中发生的主要反应的化学方程式_____________。装置C中NaOH溶液
的作用是__________________。
(3)你认为该装置是否有不足之处?______。如果有,请一一说明__________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自然
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(1)该小组“实验室制Si”的化学方程式是 。
(2)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是 。
2.某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
1.某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴ 该省大气污染特征是
A.煤烟型 B.机动车尾气型C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵ 请你提出该省防治酸雨的两条主要措施
;
。
⑶ 某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别
是 。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是 。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
HCHO+H2SO3→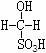
该反应类型属于 。测定时,只需向吸
 收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2
收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2
与指示剂、甲醛反应生成可溶性紫红色化合物,根据
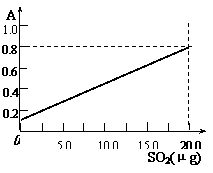
溶液颜色深浅(用吸光度A表示,可由仪器进行测量),
就能确定二氧化硫的含量。实验测得SO2含量与溶液
的吸光度A的关系如右图所示。若欲测定某地空气中
二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com