
13.下列是某同学设计的物质鉴别方案:
①用NaOH溶液鉴别:NH4Cl、AlCl3、FeCl3、MgSO4、NaHCO3五溶液
②用HCl鉴别:NaAlO2、Na2S2O3、K2CO3、Na2SiO3、Na2S五溶液
③用水鉴别:NH4NO3、NaOH、BaSO4、Cu(NO3)2、Na2O2五固体
④用Ba(OH)2溶液鉴别:FeSO4、CuCl2、Na2SO4、NH4Cl、NH4NO3五溶液
⑤用FeCl3溶液鉴别:KI、Na2SO3、Na2CO3、Na2SO4、NaOH五溶液
在不用其他试剂且不加热的情况下,上述实验方案中能够将五种试剂都鉴别出的方案有( )
A.②③⑤ B.①②③⑤
C.②③④⑤ D.全部
解析:当将所用试剂分别逐滴加入待检试剂时,①中五试剂的现象分别为:刺激性气体放出、先白色沉淀后溶解、红褐色沉淀、白色沉淀、无现象;②中五试剂的现象分别为:先白色沉淀后溶解、有气体和黄色沉淀、有无色无味气体放出、有白色沉淀、有臭鸡蛋气味气体放出;③中五试剂的现象分别为:溶解且降温、溶解且升温、不溶解、溶解形成蓝色溶液、反应且放出气体;④中五试剂的现象分别为:白色沉淀变为红褐色、蓝色沉淀、白色沉淀、刺激性气体放出、刺激性气体放出,故NH4Cl和NH4NO3不能鉴别出来;⑤中五试剂的现象分别为:无色变为褐色、溶液变浅绿色、有红褐色沉淀和气体生成、溶液呈棕黄色(Fe3+颜色)、红褐色沉淀.
答案:B
12.对照实验是研究物质性质的一种重要方法,下列不是用来做对照实验的是 ( )
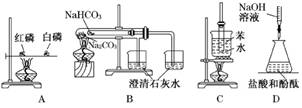
解析:本题主要考查考生对有关实验的理解能力.A图是为了把红磷与白磷着火点进行
对比;B图的装置可以比较碳酸钠和碳酸氢钠在加热条件下能否分解的实验;C图可以
比较苯和水的沸点的高低;D中白纸只是为观察溶液颜色的变化起到衬托作用.
答案:D
11.下列说法正确的是 ( )
A.用干馏的方法可将煤焦油中的苯等芳香族化合物分离出来
B.用50 mL碱式滴定管准确量取25.00 mL的KMnO4溶液
C.检验SO2中是否含有CO2,应将气体依次通过氢氧化钠溶液和澄清石灰水
D.分离苯和水时,水从分液漏斗下端流出,苯从上口倒出
解析:A项,将煤焦油中的苯等芳香族化合物分离出来的方法是分馏;B项,KMnO4
溶液有强氧化性,对碱式滴定管的乳胶管部分有腐蚀作用,故不能用碱性滴定管量取,
而应该用酸式滴定管;C项,检验SO2中是否含有CO2,应将气体依次通过酸性高锰酸
钾溶液、品红溶液和澄清石灰水.
答案:D
10.下列实验方案能达到预定目的的是 ( )
A.将SO2通入石蕊试液中证明SO2有漂白性
B.用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱
C.向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO
D.用干燥的pH试纸可测得新制氯水的pH=2
解析:A项,SO2不能漂白指示剂,能使石蕊试液变红;B项,可以根据钠、钾与冷水
反应的剧烈程度验证钠、钾金属性的强弱;C项,若溶液中含有Ag+,加入BaCl2溶液,
再加入稀硝酸时溶液中也会出现白色沉淀;D项,因氯水具有漂白性,不能用pH试纸
测氯水的pH.
答案:B
9.在下表中,欲用一种试剂Z来检验盐溶液中的离子X.在同时有离子Y存在时,此检验仍可判别的是 ( )
|
编号 |
试剂Z |
离子X |
离子Y |
|
① |
NH3·H2O |
Al3+ |
Mg2+ |
|
② |
AgNO3 |
Cl- |
CO |
|
③ |
Na2SO4 |
Ba2+ |
Mg2+ |
|
④ |
Ba(NO3)2 |
SO |
Cl- |
A.①② B.②③
C.③④ D.仅④
解析:①、②中Mg2+与CO均能对检验X离子产生干扰,而③、④中没有干扰.
答案:C
8.(2010·东城模拟)NaCl固体中混有下列杂质时,可以利用加热的方法进行提纯的是( )
A.KClO3 B.K2SO4
C.NH4Cl D.NaHCO3
解析:NH4ClNH3↑+HCl↑,故加热后可得纯净的NaCl固体.A、B、D加热后
仍会有KClO3、少量的KCl、K2SO4、Na2CO3等杂质.
答案:C
7.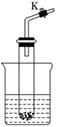 设计学生实验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(如图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散).下列气体的制取宜使用该装置的是( )
设计学生实验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(如图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散).下列气体的制取宜使用该装置的是( )
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
解析:A项,固体为粉末会掉入烧杯中使反应失去控制不能停止;C项,H2S有毒;D
项生成的CaSO4微溶于水会覆盖在碳酸钙表面阻止反应的进行.
答案:B
6.下列试剂保存方法错误的是 ( )
A.金属钠保存在煤油中
B.氢氧化钠溶液保存在广口瓶中
C.少量白磷保存在水中
D.硝酸溶液保存在棕色瓶中
解析:试剂的保存要根据物质的性质采取一定的措施.固体物质一般保存在广口瓶中,液体试剂一般保存在细口瓶中,易被氧化,易与水反应的物质要密闭隔绝空气,见光受热易分解的物质,要避光、阴凉处保存.钠易与O2、H2O反应,白磷易与O2反应,HNO3见光易分解,故B项错误.
答案:B
5.下列实验方案可行的是 ( )
A.检验溶液中是否有SO时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失
B.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中是否含有乙
烯
C.选用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液
D.检验溶液中是否含有CO时,加入稀盐酸,将产生的气体通入澄清石灰水
解析:A实验中Ag+或SO会产生干扰;B实验中乙醇与浓硫酸共热生成的气体中含有
SO2,SO2也能使酸性KMnO4溶液褪色;D实验中HCO、SO、HSO等离子会产生
干扰.
答案:C
4.进行化学实验必须注意安全,下列说法不正确的是 ( )
A.不慎将少量酸溅到眼中,应立即用水洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.酒精着火时,可用湿抹布将其扑灭
D.配制稀硫酸时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
解析:硼酸作为一种弱酸,不会对皮肤有伤害,却能起到中和碱的作用;量筒作为一种度量工具,不管是从其使用的注意事项(不能用于配制溶液),还是从稀释浓硫酸时放热将影响量筒的准确度甚至发生炸裂的方面考虑D都不可行;A项中的边洗边眨眼的目的是把眼睛中的酸挤出、冲掉,再让纯水进入眼中,使酸液不断被水冲稀、挤出.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com