
1.下列操作能使水的电离平衡向移动,而且溶液呈酸性的是 A、加入小苏打 B、滴加稀硫酸 C、加入FeCl3·6H2O晶体 D、加入NaOH
2.例题解析
例1. 将0.1 mol·L-1 CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液的PH增加
B. CH3COOH电离度变大
C. 溶液的导电能力减弱
D.溶液中[OH-]减小
解析. CH3COOH溶液中存在着CH3COOH的电离平衡,加水稀释平衡向正反应方向移动,电离度增大,溶液中的[H+]减少,[OH-]增大,PH增大;加入少量CH3COONa晶体时,平衡向逆反应方向移动,电离度减小,[H+]减少,[OH-]增大,PH增大。
例2.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s) B.NaHCO3(s)
C.Na2S04(s) D.CH3COONa(s)
解析 A.加NaOH固体能减缓反应速率,但要消耗H+,减少氢气总量。
B.加NaHCO3(s)与盐酸反应消耗H+,减少H2总量。
C. NaHS04(s)溶解后电离出H+导致产生H2的量增大。
D.CH3COONa能与盐酸生成弱电解质CH3COOH减缓反应速率,但不影响H2总量。
答案D
例3.一种PH=3的酸溶液和一种PH=11的碱溶液等体积混合后测得溶液的PH=5.6其原因可能是:( )
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
分析:酸和碱溶液混合后显酸性,其原因可能是:
①两种溶液恰好完全反应,但参于反应的是强酸和弱碱,生成的强酸弱碱盐水解而使溶液显酸性。
②酸和碱没有恰好反应,反应后酸有余,因而溶液显酸性。
例4.将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是( )
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4
解析:此题涉及到物质溶解性、盐的水解等知识.往往对盐的水解产生一种错误理解,即CO32-因水解而使CO32-浓度减小,本题已转移到溶液中阴离子总数多少的问题上。
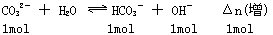
由此可知,若有1molCO32-水解,则能产生1molHCO3-和1molOH-,水解方向是阴离子数目增多的方向。故C中阴离子数>0.1mol,.A、D中n(Cl-) =n(SO42-) =0.1mol(水电离出OH-可忽略),B中的Mg(OH)2在水中难溶,故溶液中n(OH-)<0.1mol.
本题答案:C
基础训练
3. 热纯碱溶液的去污能力为何比冷的强?配制硫酸铜溶液为何需要加硫酸?
学习导航
2. 解释泡沫灭火器的原理。(硫酸铝溶液和碳酸氢钠溶液)
1. 如何判断盐溶液的酸碱性?
5.盐类水解的实质____________________________,条件__________________________,特征____________________规律_________________________________________________________________, 表示方法:强酸弱碱组成的盐,______(阳、阴)离子水解,一般一步水解,如氯化铝______________,强碱弱酸组成的盐,________离子水解,多元弱酸根分步水解,如碳酸钠____________________。
4.醋酸钠溶液显_________性,解释原因______________________________。增加溶液中溶质的量,使盐的浓度加倍,水解平衡向_______(左、右)移动,水解程度________;将盐的浓度稀释为原来的一半,水解平衡向_______(左、右)移动,水解程度________;向溶液中滴加少量农盐酸,水解平衡向_______(左、右)移动,水解程度_______;向溶液中滴加少量浓氢氧化钠溶液,水解平衡向________(左、右)移动,水解程度________;
3.__________表示弱电解质在水中的电离程度,温度相同、浓度相同时,不同弱电解质的______________是不同的。同一弱电解质在不同浓度的水溶液中,其___________也是不同的,溶液越______,电离度越大。
2. 影响电离常数的因素有哪些?分别是怎样影响的?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com