
4、在解决直线与圆的位置关系问题中,要善于运用圆的几何性质以减少运算
3、熟练掌握求直线方程的方法(如根据条件灵活选用各种形式、讨论斜率存在和不存在的各种情况、截距是否为0等等)
2、熟练掌握基本公式(如两点间距离公式、点到直线的距离公式、斜率公式、定比分点的坐标公式、到角公式、夹角公式等)
1、准确理解基本概念(如直线的倾斜角、斜率、距离、截距等)
纵观2006年全国各省市18套文、理高考试卷,普遍有一个规律:占解几分值接近一
半的填空、选择题难度不大,中等及偏上的学生能将对应分数收入囊中;而占解几分值一
半偏上的解答题得分很不理想,其原因主要体现在以下几个方面:(1)解析几何是代数与
几何的完美结合,解析几何的问题可以涉及函数、方程、不等式、三角、几何、数列、向
量等知识,形成了轨迹、最值、对称、范围、参系数等多种问题,因而成为高中数学综合
能力要求最高的内容之一(2)解析几何的计算量相对偏大(3)在大家的“拿可拿之分”
的理念下,大题的前三道成了兵家必争之地,而排放位置比较尴尬的第21题或22题(有
时20题)就成了很多人遗忘的角落,加之时间的限制,此题留白的现象比较普遍。
鉴于解几的特点,建议在复习中做好以下几个方面.1.由于高考中解几内容弹性很
大。有容易题,有中难题。因此在复习中基调为狠抓基础。不能因为高考中的解几解答题
较难,就拼命地去搞难题,套新题,这样往往得不偿失;端正心态:不指望将所有的题攻
下,将时间用在巩固基础、对付“跳一跳便可够得到”的常规题上,这样复习,高考时就
能保证首先将选择、填空题拿下,然后对于大题的第一个小问争取得分,第二小题能拿几
分算几分。
高考解析几何试题一般共有3--4题(1--2个选择题, 0--1个填空题, 1个解答题), 共计20多分, 考查的知识点约为20个左右,其命题一般紧扣课本, 突出重点, 全面考查。选择题和填空题考查直线, 圆, 圆锥曲线中的基础知识,大多概念性较强,小巧灵活,思维多于计算;而解答题重点考查圆锥曲线中的重要知识点及其综合运用,重在考察直线与圆锥曲线的位置关系、轨迹方程,以向量为载体,立意新颖,要求学生综合运用所学代数、三角、几何的知识分析问题,解决问题。
23、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2 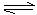 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A、等于p% B、小于p% C、大于p% D、无法判断
(1)设有体积相同的两个容器甲和乙,已知甲装有SO2和O2各1g,乙装有SO2和O2各2g。在相同温度下反应达到平衡时,甲中SO2的转化率为a%,乙中SO2的转化率为b%。则a与b的大小关系是
A、a>b B、a=b C、a<b D、无法确定
(2)恒温恒压下,在容积可变的器皿中,反应2NO2(g) N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A. 不变 B. 增大 C. 减少 D. 无法判断
(3)在一密闭容器中充入1molNO2,建立如下平衡:2NO2 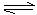 N2O4,平衡时测得NO2的转化率为a%。在其他条件不变下,再充入1molNO2,待新平衡建立时,NO2的转化率为b%,则a、b值的大小关系是( )
N2O4,平衡时测得NO2的转化率为a%。在其他条件不变下,再充入1molNO2,待新平衡建立时,NO2的转化率为b%,则a、b值的大小关系是( )
A、a>b B、a=b C、a<b D、无法确定
(4)一真空密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:
PCl5(g)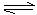 PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2molPCl5,反应平衡时,PCl5所占的体积分数为N%。则M和N的正确关系是
PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2molPCl5,反应平衡时,PCl5所占的体积分数为N%。则M和N的正确关系是
A、M>N B、N>M C、M=N D、无法比较
(5)恒温恒压下,将1molA和1molB放入一个起始容积为VL的可变容积的容器中,发生如下反应:A(g)+B(g)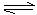 C(g),达到平衡后,生成amolC。若维持温度不变,在一个容积固定为VL的容器中放入1molA和1molB,发生反应,达到平衡后,生成bmolC。将b与a进行比较
(选填一个编号)
C(g),达到平衡后,生成amolC。若维持温度不变,在一个容积固定为VL的容器中放入1molA和1molB,发生反应,达到平衡后,生成bmolC。将b与a进行比较
(选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是
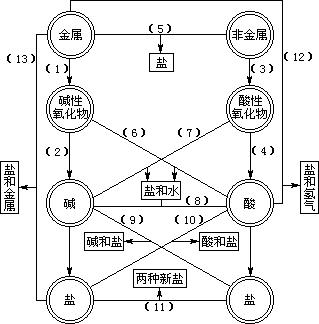
(三)、图中每一反应规律,对反应物而言是它的一种化学性质,对生成物来说是它的一种可能制法,因此,在实际生产和物质制备中,除考虑反应的可能性外,还需根据原料、试剂、设备等条件选用最合适的途径。
(二)、各类物质相互反应的条件:即对反应物生成物的性质要求:
1、金属+氧气→碱性氧化物
2、碱性氧化物+水→可溶性碱
3、非金属+氧气→酸性氧化物
4、酸性氧化物+水→可溶性含氧酸
5、金属+非金属→无氧酸盐
6、碱性氧化物+酸→盐+水
7、酸性氧化物+碱→盐+水
8、碱+酸→盐+水
9、可溶性碱+可溶性盐→新碱+新盐[生成物中有一种沉淀或气体(如NH3)]
10、酸+盐→新盐[生成物具有挥发性成分或分解成气体(如CO2),或盐难溶]
11、可溶性盐+可溶性盐→新盐+新盐(有一种盐难溶)
12、排在H前的金属+酸→盐+氢气
13、活泼金属+较不活泼金属可溶性盐→新金属+新盐(活泼金属不包括K、Ca、Na)
从上述所列的 6-13均为复分解反应,生成物都有沉淀析出,或气体放出,或水生成,这就是复分解反应发生的条件。
(一)、各类物质的相互转化关系和在一定条件下相互转变的规律可用下图表示:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com