
8.(淮安市2009届高三年级十月四校联考)(13分)现有一种铜粉与氧化铜粉末的混合物
(1)经测定该混合物中铜元素与氧元素的质量之比为6:1,则混合物中铜粉与氧化铜的物质的量之比为 ;
(2)112g上述混合物在加热条件下与足量的浓硫酸充分反应后,产生SO2的物质的量为 mol;
(3)若铜粉与氧化铜粉末的混合物中氧元素的质量分数为0.1,则160g该混合物在加热条件下与足量的浓硫酸反应,消耗硫酸的物质的量为 mol;
(4)设混合粉末中氧元素的质量分数为x,160g该混合物与足量的浓硫酸反应,消耗硫酸的物质的量为y mol,写出x的取值范围 ,及y与x之间的关系式 。
[请写出第(3)小题的计算过程]
答案.(1)1:2 (2分)
(2)0.5 (2分)
(3)3.5 (2分)
解:m(氧元素) =160×0.1=16(g) ∴ n (CuO)= n (氧元素)= 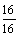 =1 (mol) m(CuO) =80g
=1 (mol) m(CuO) =80g
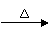 ∴m(Cu) =160-80=80(g) n (Cu)=
∴m(Cu) =160-80=80(g) n (Cu)= 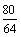 =1.25 (mol)
=1.25 (mol)
Cu + 2H2SO4 CuSO4+SO2↑+2H2O CuO + H2SO4 → CuSO4+H2O
7.(江苏省南京市2009届高三年级质量检测)(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上制备无水AlCl3的方法是:将一定粒度的铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按一定配比投入焙烧炉中加热至800℃,再将焙烧过的物料投入到氯化炉中,然后通入Cl2和O2,于950℃在石油焦还原剂的存在下,Al2O3跟Cl2反应,生成气态的AlCl3经冷却后得到氯化铝粗产品(杂质的成分是FeCl3)。尾气中含有大量CO和少量Cl2,用碱液或Na2SO4溶液除去Cl2,并回收CO。精制AlCI3粗产品一般用升华法。在升华器内,加入NaCl固体,同时加入少量某种物质X,将FeCl3杂质还原成Fe作为废渣除去,再经升华就得到精制的AlCl3。回答下列问题:
(1)氯化炉中通入O2的目的是 。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(3)用Na2SO3溶液处理尾气时发生反应的离子方程式是 。
(4)精制AlCl3粗产品时,需加入少量物质X。X可能是下列物质中的 。(填
字母)
A.FeCl2固体 B.Fe粉 C.Al粉
(5)精制无水AlCl3合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。试计算该样品中AlCl3的质量分数(写出计算过程)。
答案..(10分)
(1)跟C反应,提供反应所需要的热量。(1分)
高温
(2)A12O3+3C12+3C 2A1C13+3CO(1分)
(3)SO32-+C12+H2O SO42-+2C1-+2H+(1分)
(4)C(1分)
(5)解:2FeC13 - 2Fe(OH)3 - Fe2O3 (2分)
2×162.5 160
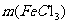 0.16g
0.16g
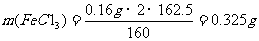 (2分)
(2分)
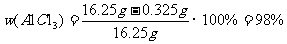 (2分)
(2分)
6.(江苏省前黄高级中学2008-2009学年第一学期高三期中试卷)(8分)铁及其化合物之间的相互转化可用下式表示:
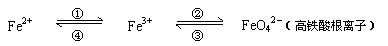
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)
则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金 b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂 d.当转移1mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钾作为水处理剂发挥的作用是_______、_________。
答案..(8分)(1)d(2分); (2)d(2分);
(3)2、6、2、2、2、1(2分)
(4)净水、消毒(各1分,共2分)
5.(江苏如皋市搬经镇中2009届高三第一学期期中)(4分)根据要求书写出正确的化学方程式。
(1)实验室用过氧化氢和二氧化锰混合制氧气的反应原理:
;
(2)电解水实验的原理 ;
(3)颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”
①在高温条件下,用H2与FeCl2反应,可生成“纳米铁”和HCl气体,写出该反应的化学方程式: ;
②“纳米铁”在空气中受到撞击时会燃烧,其反应与铁在空气中燃烧相同,写出该反应的化学方程式: 。
4。(江苏省2009年高考化学模拟测试试卷)(10分)现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
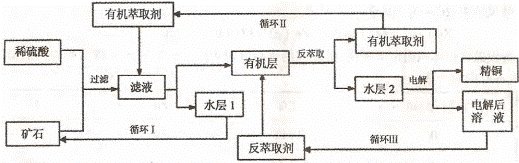
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。某肟类化合物
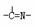
A的分子结构中仅含n1个-CH3、n2个-OH和n3个三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(5)该工艺最大亮点是它符合下列原理 。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。
A.两种方案 B.三种方案 C.四种方案 D.五种方案
答案..(1)CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
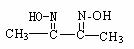 (2)4Fe2++O2+4H+=4Fe3++2H2O
(2)4Fe2++O2+4H+=4Fe3++2H2O
(3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2 (5)B(6)A
3.(江苏省奔牛高级中学2008-2009学年度高三第二次调研)(14分)在中学化学实验中,通常用无水硫酸铜检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于 中研碎后放入坩埚,将坩埚放在
上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入 中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是 ;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是 ,所用的主要玻璃仪器有蒸馏烧瓶、温度计、承接管(牛角管)、锥形瓶 等。
 (3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想 。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想 。
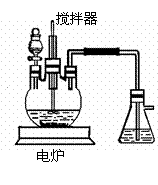
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
[问题一]如图装置中,分液漏斗内装的液体是 ,反应结束时,获取CuSO4•5H2O的操作过程是先撤去导管,后停止加热。趁热将三颈瓶中的液体倒入烧杯中 。
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是 。
答案..(14分)方法甲:研钵、泥三角、干燥器(各1分,共3分)
|
|
(1)CuSO4·5H2O═CuO+SO3+5H2O或CuSO4·5H2O═CuO+H2SO4+4H2O也可。(2分)
(2)吸水剂,加CaO后蒸馏(或蒸馏也可),冷凝管。(各1分,共3分)
(3)铜离子对双氧水分解有催化作用。(2分)
(4)[问题一]浓硝酸(1分),冷却、结晶、过滤。(1分)
[问题二]NO2+NO+Ca(OH)2=Ca(NO2)2+H2O(2分)
2.(江苏省奔牛高级中学2008-2009学年度高三第二次调研)把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,此时若
滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是[D ]
A.SO2 B.Fe2+ C.Fe3+ D.NO3-
1.{江苏省赣榆高级中学09高三年级十二月 }有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是[ C ]
A.氧化剂与还原剂的物质的量之比为1:8
B.该过程说明Fe( NO3)2溶液不宜加酸酸化
C.若有l mol NO3-发生氧化反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
20、(1)
|
实验一 |
|
|
时间较长、温度较高 2KClO3=2KCl+3O2↑ |
|
实验三 |
将MnO2与KClO3的混合物加热 |
|
|
(2)对比(或比照等);
(3)第一方面:比较MnO2在KClO3分解前后的质量;
第二方面:验证从反应后的剩余物中分离出的物质是否能加快KClO3的分解。
|
|
 ⑵ H2O2 ----→ H2O + O2 KMnO4 ----→ K2MnO4
+ MnO2 + O2
⑵ H2O2 ----→ H2O + O2 KMnO4 ----→ K2MnO4
+ MnO2 + O2
 KClO3 ------→ KCl + O2
KClO3 ------→ KCl + O2
⑶ B 装置气密性差(或收集的氧气中含有大量的水蒸气)
⑷ 试管口没有塞棉花
⑸ b
⑹ A D或E
19、⑴Fe+O2Fe3O4 (铁+氧气  四氧化三铁 ) 黑 防止高温生成物溅落下来炸裂瓶底
四氧化三铁 ) 黑 防止高温生成物溅落下来炸裂瓶底
⑵ 蓝紫色 S+O2SO2 (硫+氧气  二氧化硫
) 水或氢氧化钠溶液 吸收二氧化硫,防止污染空气。
二氧化硫
) 水或氢氧化钠溶液 吸收二氧化硫,防止污染空气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com