
18.(江苏省扬州中学2008-2009学年第一学期第一次月考)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
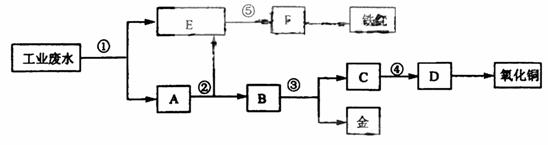
填写下面空白。
(1)图中标号处需加入的相应物质分别是:
① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;
写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。

答案. (1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2) ① Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
③ 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
17.(江苏省姜堰市2008-2009学年度第一学期期中考试)已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O = 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是[ C]
A.该反应中Fe2+是还原剂,O2是还原产物
B.4molNa2O2在反应中共得到8NA的电子
C.Fe(OH)3是氧化产物,每生成4mol Fe(OH)3反应过程中共转移电子6mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
16.(江苏省姜堰市2008-2009学年度第一学期期中考试)(12分)铜及铜的化合物有多种应用。请回答下面相关问题:
|
|
②Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O
假如某工厂欲生产CuSO4,请选择一种方法并说明理由
。
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因 。
如果铜片在稀硫酸中加热时滴入几滴H2O2, 溶液也会很快呈蓝色,请用离子方程式表示原因 。
(3)已知2Cu(s)+1/2 O2(g) = Cu2O(s) ;△H 1= –12.0kJ/mol
2Cu(s)+S(s) = Cu2S(s) ;△H2 = –79.5kJ/mol
S(s)+ O2 (g) = SO2(g) ;△H3 = –296.83kJ/mol
求Cu2S(s)+2 Cu2O(s) =6 Cu(s)+ SO2(g) △H4= kJ/mol
|
已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□ HNO3==== □CuSO4+□Cu(NO3)2+□NO↑+□
化学兴趣小组同学欲分析黑色固体的成分,设计了如下实验方案:先称取样品m1g,然后充分加热反应后测得生成CuO质量为m2g,则样品中含Cu2S g。
答案.
|
|
(2)2Cu+O2+2H2SO4 = 2CuSO4+2H2O Cu+H2O2+H2SO4==CuSO4+2H2O
(3)△H4 = –193.33kJ/mol
(4)3,16, 3, 3,10 , 8H2O
6m2-5m1 ( 每空2分,共12分)
15.(泰兴市第一高级中学2009届高三年级第五次周考)为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是[B ]
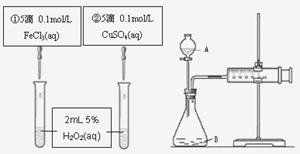 A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为
①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
 C.用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
C.用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭A处活塞,
将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
14、(常州一中2009届12月高三化学月考)(12分)
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤
 进行:
进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
操作II必须用到的仪器是 。(填下列编号)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,
加入氨水要过量的原因是 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)
答案.(1)250mL容量瓶、胶头滴管 -------------(各1分) D-----------------------(1分)
(2)2Fe 2+ + Br2 = 2Fe 3+ + 2Br- -------(1分) 使Fe3+充分沉淀 ----------(1分)
(3)取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净(合理的答案均可得分)--------------------------(2分)
(4)再次加热冷却并称量,直至两次质量差小于0.1g --------------------------------------(2分)
(5)铁元素的质量分数是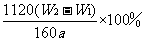 -------------------------------------------(2分)
-------------------------------------------(2分)
原因可能是: 固体加热时未充分反应变为 Fe2O3- ------------------------------------(1分)。
13.(江苏省口岸中学09届秋学期高三年级第二次月考)(10分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
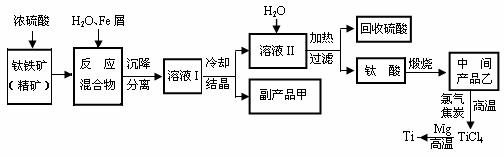 回答下列问题:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
⑵ 上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 。
答案.⑴ FeSO4·7H2O ⑵ 防止Fe2+氧化 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色 ⑶ 稀盐酸
 ⑷ TiO2 Ti+O2↑
⑷ TiO2 Ti+O2↑
12.(江苏省口岸中学09届秋学期高三年级第二次月考)向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为[ B]
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
10.(淮安市2009届高三年级十月四校联考)某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:


方案I:铜铝混合物 测定生成气体的体积

方案II:铜铝混合物 测定剩余固体的质量
列有关判断中不正确的是 [B]
A. 溶液A和B均可以是盐酸或NaOH溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用浓硝酸,则测得铜的质量分数偏小
D. 实验室方案II更便于实施
 11(江苏省射阳中学2009届高三第二次月考).(8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
11(江苏省射阳中学2009届高三第二次月考).(8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度= n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质 的量。试回答下列问题。
(1)写出在酸性介质中用NaClO3氧化FeSO4·7H2O的离子方程式。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
(3)计算出该固体聚合硫酸铁样品的化学式。
答案. 解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol
n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (2分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45·54H2O (2分)
9.(淮安市2009届高三年级十月四校联考)(8分)铁及其化合物之间的相互转化可用下式表示:
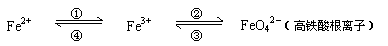
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)
则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,有46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______、_________。
答案.(1)d(2分); (2)d(2分); (3)2、6、2、2、2、1(2分)
(4)净水、消毒(各1分,共2分)。
1.25 mol 2.5 mol 1mol 1mol
∴ n (H2SO4)= 2.5+1=3.5(mol) (3分)
(4)0<x<0.2 (2分), y=5-15x (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com