
18.一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜。铁在不同浓度的硝酸中溶解与钝化情况如图如示。试探究下列问题:
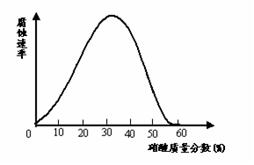
(1)现有一枚光亮的铁钉,欲使其表面形成钝化层,应将其放入浓度大于 的硝酸中一段时间;证明其表面已形成一层致密的钝化层的简单实验是: 。
(2)下列有关说法不正确的是 (选填序号)。
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平:
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: 。
17.2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
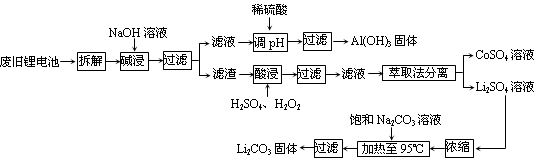
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 。
(3)碱浸时主要反应的离子方程式为 。
(4)酸浸时反应的化学方程式为 。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是 。
(5)生成Li2CO3的化学反应方程式为 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应注意的问题是 。
16.下图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白:
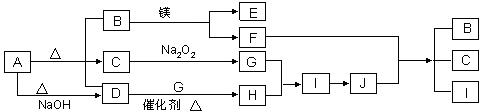
(1)A的化学式 B的电子式 。
(2)写出下列反应的化学方程式:
D+G→ H
F+J → B + C + I
(3)写出A+NaOH→D的离子方程式
15.黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]测定硫元素的含量
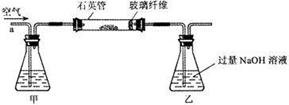 Ⅰ.将m1
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
Ⅰ.将m1
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
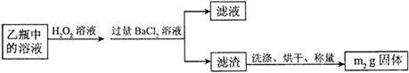
问题讨论:
(1)上述装置图中,甲瓶内所盛试剂是 溶液。
(2) 向乙瓶溶液中滴加H2O2溶液时,发生反应的离子方程式为 。
(3)除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)
①氯水 ②浓硫酸 ③硝酸 ④FeCl3
(4)该黄铁矿中硫元素质量分数的表达式为 。
[实验二]设计以下实验方案测定铁元素的含量
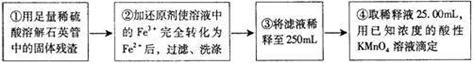
(5)步骤②中,若选用铁粉作还原剂,对测定结果的影响为 (填写“偏低”、“无影响”或“偏高”)。
(6)步骤③、④中,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、锥形瓶以外,还有 。滴定终点时溶液颜色为 色。
14.把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是 ( )
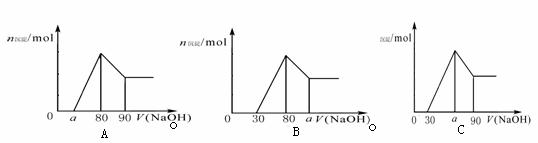
A.a的取值范围为 0≤a<50
B. 的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
第Ⅱ卷(非选择题 共78分)
13.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是 ( )
A.最终得到7.8g的沉淀
B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=1.5mo/L
D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
12.下列各组物质中,满足下图物质一步转化关系的选项是 ( )
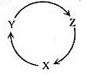
|
选项 |
X |
Y |
Z |
|
A |
NO |
NO2 |
HNO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2SiO3 |
11.下列实验操作或装置符合实验要求的是 ( )
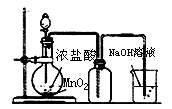
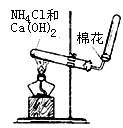
A.实验室制备氯气 B.实验室制备氨气
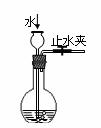
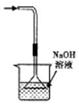
C.检查装置气密性 D.吸收HCl气体
10.从碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是 ( )
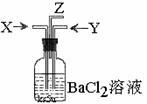
A.洗气瓶中产生的沉淀是碳酸钡 B.Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡 D.Z导管口有红棕色气体出现
9.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是 ( )
A.沸点:X的氢化物>Y的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX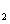 、M
、M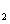 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com