
7.根据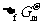 的数据计算298K时AgBr的Ksp值是( )
的数据计算298K时AgBr的Ksp值是( )
A.5.4×10-13 B.2.1×10-12 C.3.6×10-4 D.4.4×10-20
6.下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小;
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好;
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净;
D.欲使Ca2+离子沉淀最完全,选择Na2C2O4作沉淀剂效果比Na2CO3好。
5.下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
4.向同浓度的Cu2+、Zn2+、Hg2+、Mn2+离子混合溶液中通入H2S气体,则产生沉淀的先后次序是( )
A.CuS、HgS、MnS、ZnS; B.HgS、CuS、ZnS、MnS;
C. MnS、ZnS 、CuS、HgS、 D. HgS、ZnS、CuS、MnS
3.下列沉淀能溶解于盐酸的是( )
A.HgS; B.Ag2S C.MnS; D.CuS
2.在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀( )
A.溶解; B.增多; C.不变; D.无法判断
1.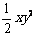 难溶电解质AB2饱和溶液中,c(A+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为( )
难溶电解质AB2饱和溶液中,c(A+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为( )
A. ; B.xy; C.xy2 D.4xy2
0.00192 g ·L-1 /143.3 g/ mol-1 =1.34×10-5mol·L-1
根据AgCl在溶液中的离解:
AgCl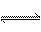 Ag+ + Cl--
Ag+ + Cl--
溶液中应有 [Ag+]=[Cl-]=1.34×10-5 mol·L-1
所以AgCl的Ksp= [Ag+][Cl-]=(1.34×10-5 ) 2=1.80×10-10 mol2.L-2
例2.18℃时,Mg(OH)2的Ksp=1.8×10-11 mol3.L-3求饱和溶液中Mg2+的浓度。
解: 设Mg(OH)2中Mg2+的浓度为x mol·L-1,根据Mg(OH)2在溶液中的离解:
Mg(OH)2 Mg2+ + 2OH--
Mg2+ + 2OH--
溶液中应有[Mg2+]=χmol.L-1 [OH-]=2χmol.L-1
Ksp=[Mg2+][OH-]2=χ.(2χ)2=1.8×10-11mol3.L-3
χ=1.65×10-4(mol.L-1)
答:饱和溶液中Mg2+的浓度为1.65×10-4mol.L-1
基础训练
2. 例题解析
例1. 25℃时,AgCl的溶解度是0.00192g ·L-1,求它的溶度积.
解析. AgCl的相对分子质量为143.3, AgCl饱和溶液物质的量浓度为:
1. 方法导引
(1)用类比的方法,从化学平衡出发,引出沉淀平衡也属于化学平衡,因此具有化学平衡的共同特点,从而很容易理解溶度积及影响沉淀平衡的条件。在此必须强调研究的对象是难溶的电解质,达到平衡时所得溶液为饱和溶液,推出Ksp和溶解度S的关系。溶度积Ksp和溶解度S的数值都可用来表示不同物质的溶解能力。但用溶度积直接比较时,必须是相同类型的难溶化合物。Ksp与S换算时,S的单位必须用物质的量浓度(mol·1-1或mol·dm-3)。
(2)根据溶度积常数Ksp与浓度商QC的关系可以判断沉淀溶解平衡移动的规律,称为溶度积规则。对于难溶电解质AmBn,浓度商QC表示为:
QC= [An+] m[Bm-]n
若QC<Ksp溶液为未饱和溶液,体系中无沉淀生成
若QC=Ksp为饱和溶液,体系处于平衡状态
若QC>Ksp为过饱和溶液,体系中有沉淀生成
(3)由一种沉淀转化为另一种沉淀的过程称为沉淀的转化。若难溶解电解质类型相同,则Ksp较大的沉淀易于转化为Ksp较小的沉淀;用此原理 可以解释自然界的某些现象及在工业上进行废水处理、物质制备等。
(4)在一定条件下,使一种离子先沉淀,而其它离子在另一条件下沉淀的现象叫作分步沉淀或称选择性沉淀。
对于同类的沉淀物(如MA型)来说,Ksp小的先沉淀,但对不同类型的沉淀物就不能根据Ksp值来判断沉淀先后次序。
当一种试剂能沉淀溶液中几种离子时,生成沉淀所需试剂离子浓度越小的越先沉淀;如果生成各种沉淀所需试剂离子的浓度相差较大,就能分步沉淀,从而达到分离离子目的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com