
7、(金丽衢十二校高三第一次联考化学模拟)(1)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I– 2CuI↓+ I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈现蓝色,对这个现象解释正确的是:_____________(填序号)。
①阴极电极反应2H+ + 2e – H2↑,使c (OH – ) > c (H+)
②阳极2Cu + 4I – – 4e – 2CuI↓+ I2,I2遇淀粉变蓝
③阳极Cu – 2e – Cu2+,Cu2+ 显蓝色
④阳极2I – – 2e – I2,碘遇淀粉变蓝
(2)剪约6 cm长,2 cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40 mL浓HNO3,另一只烧杯中注入40 mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。电流表指针偏向________(填“铝”或“铜”)
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_______________。电流表指针偏向________(填“铝”或“铜”)
答案(1)①② (3分)
(2)①Al作负极, Al – 3e – Al3+。铜
②铜作负极, 2NO3
– + 2e – + 4H + 2NO2↑+ 2H2O。Al
(7分)
5.(08年3月浙江省温州市十二校高三第二学期第一次月考)用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol
Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
6 (金丽衢十二校高三第一次联考化学模拟).可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应( A )
①Br2+2e=2Br- ②2Br--2e=Br2 ③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
4.(08年3月浙江省温州市十二校高三第二学期第一次月考)下图所涉及的物质均为中学化学中常见的物质,其中C、D、E为单质,其余为化合物,其中纳米F晶体材料可作为核磁共振造影增强剂,可用于疾病的诊断和药物载体,它们之间存在如下转化关系(部分产物已省略)。
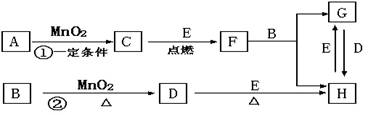
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)____________;若反应①是在常温条件下进行的,则A是(填化学式)_____________;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为_____________。
(2)H用途广泛如用作催化剂,印刷电路腐蚀剂和外伤止血剂及净水等。若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
___________________ ______。总离子方程式为:__________ _______________。
F与B反应的离子方程式为:________ _________________。
(3)如经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式:______________________________________________________________________________。
A与氨气反应生成的酸式盐的化学式为:_________________________。
Da’an
(1)KClO3,H2O2,2:1 (2)2Fe3++2e-=2Fe2+ , 2Fe3++Cu=2Fe2+ +Cu2+ Fe304+8H+= 2Fe3++Fe2++4H2O
(3)H2O2
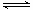 H++HO2 - (HO2+
H++HO2 - (HO2+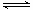 H++O22-) NH4HO2
H++O22-) NH4HO2
MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。
3、(温州市十校联合体高三联考)航天技术上使用的一种氢氧燃料电池,具有高能轻便,不污染环境等优点,该电池总反应方程式为:2H2+O2 =2H2O, 该电池的正极变化可表示为
A. 4H+ +4 e- =2H2 ↑ B. 4OH--4e- =O2↑+ 2H2O
C.O2 + 2H2O +4e- = 4OH- D. 2H2-4e- = 4H+
2.(温州市高三第二次“八校联考”)下列叙述不正确的是
A.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应
B.电解精炼铜时,纯铜作阴极,Cu2+发生还原反应
C.铜锌原电池中,锌作负极,电子从锌极流向铜极
D.铅蓄电池在放电时,电解质溶液中SO42-移向负极
1.(2008年杭州学军中学高考模拟测试5月)镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2= Mg2++2H2O。关于该电池说法正确的是
A.放电时H+在正极反应得电子
B.正极方程式为:H2O2+2e-=2OH-
C.镁合金为电源负极,发生氧化反应
D.放电时正极的pH降低
22.
 已知某可逆反应mA(g)+
nB(g) pC(g);⊿H?。在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
已知某可逆反应mA(g)+
nB(g) pC(g);⊿H?。在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
A、T1<T2、P1>P2、m+n>P1,⊿H <0;
B、T1>T2、P1<P2、m+n>P1、⊿H >0;
C、T1<T2、P1>P2、m+n<P1,⊿H <0;
D、T1>T2、P1<P2、m+n<P1、⊿H >0;
21.关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子 B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高 D、分子晶体的熔点一定比金属晶体的低
20.2001年11月17日网易报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制造出新型氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,下列有关O4的说法不正确的是
A、O4与O2、O3都是氧的同素异形体; B、合成O4的反应可看作核聚变反应;
C、O4分子存在极性共价键;
D、O4能量密度比普通氧分子高,将来可用作更强力的火箭推进的氧化剂。
19.下列说法不正确的是 ( )
A、1molNa做还原剂时可提供出NA个电子; B、71gCl2变成氯离子时失去的电子数为2NA
C、17gNH3与22.4升CH4所含质子数相等; D、NA个氧分子与NA个氢分子的质量比为16:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com