
5.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)
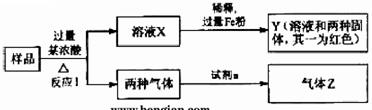
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是____________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是______。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是__________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)__________。
答案.. (1)Al
(2)① C+2H2SO4(浓)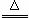 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3
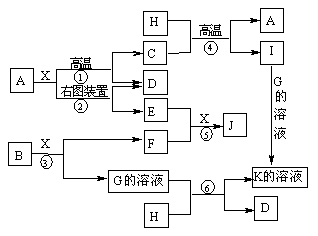
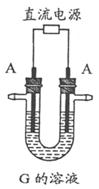 6.[江苏省姜堰市姜淮培训中心2009届高三化学周练九](10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
6.[江苏省姜堰市姜淮培训中心2009届高三化学周练九](10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
答案.. ⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
7 [江苏省口岸中学2009届高三年级第二次月考化学试题](15分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物反应:
;
②H2C2与EC2反应:
。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。比元素B原子序数大5的元素基态原子电子排布式是 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以 和 杂化成键,分子中共形成 个σ键, 个π键。
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素的电负性 d .含氧酸的酸性
e .氢化物中X-H键的键长(X代表C和I两元素) f.两单质在自然界的存在
答案..除2个化学方程式各2分外,其余每空1分
(1)B(2)①C+4HNO3==CO2+4NO2+2H2O ②2Na2O2+2CO2==2Na2CO3+O2
(3) PCl3 或CCl4 的电子式(略) 原子 1S22S22P63S23P63d54S1或[Ar] 3d54S1
(4) SP3、SP2 7 1 (5)氮 ce
4、[江苏省姜堰市姜淮培训中心2009届高三化学周练九].根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
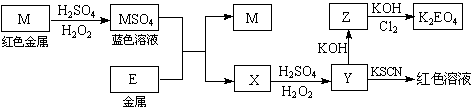
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。

 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
答案.. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I- == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
3.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
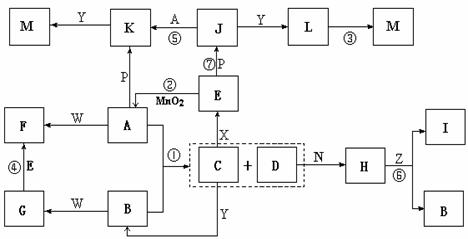
请按要求回答:
⑴写出B的结构式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
答案.⑴ Mg(OH)2 (每空2分)
⑵4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
⑶ Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分)
⑷C为固体,X为浓溶液 无氧(每空1分)
2.[江苏省启东中学2009届高三第一学期第二次月考 ](8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作
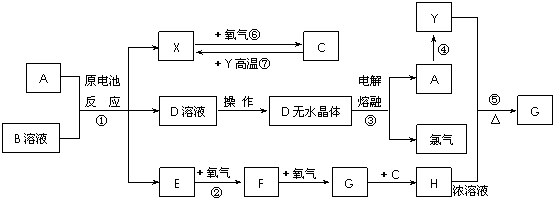 电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
|
|
|
1.[江苏省启东中学2009届高三第一学期第二次月考 ] (10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
答案..(10分) (1)c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)> c(CO32-)
或c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)(2分)
(2)2A13++3SO2-4+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O(2分)
(3)OH-(aq)+H+(aq)=H2O(1);△H=-a KJ/mol
或(a)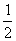 Ba(OH)2(aq)+2HC1(aq)=
Ba(OH)2(aq)+2HC1(aq)=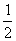 BaC12(aq)+H2O;△H=a
KJ/mol
BaC12(aq)+H2O;△H=a
KJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O;△H=-2a KJ/mol(3分,物质聚集状态、反应热任一方面错都不给分)
(4)0.01mol(3分,无单位只给1分)
13. (浙江省开化中学08年1月高三模拟) 1 L 1 mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16 g时,下列判断不正确的是
A. 溶液浓度仍为1mol/L B. 阳极上产生112 mLO2(标准状况)
C. 转移的电子数是1.204×1022个 D. 反应中有0.02 mol金属被氧化
11.(舟山中学2008学年第二次月考)在250C时,将两个铜电极插入一定量的Na2SO4饱和溶液中,进行电解,通电一段时间后,阴极逸出amol气体,同时有WgNa2SO4.10H2O晶体析出,若温度不变,剩余溶液里溶质质量分数是
A: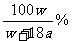 B:
B: C:
C: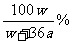 D:
D: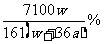
10.(舟山中学2008学年第二次月考)下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化作用
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
9.(浙江九所重点中学高三年级调研考试)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是_______________________________________,若要确认食盐中还含有K+,方法是____ __________________________________________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
答案.⑴IO3-+5I-+6H+=3I2+3H2O 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+(答取上述反应后溶液进行实验不给分) (4分)
⑵阳极 I-+3H2O-6e-=IO3-+6H+ 变大 (4分)
8. (杭州市2008年高三第一次高考科目教学质量检测化学)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是
(杭州市2008年高三第一次高考科目教学质量检测化学)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是
A. C(I)的电极名称是阴极
B.C(II)的电极名称是负极
C.C(I)的电极反应式是2H++2e-=H2↑
D.C(II)的电极反应式是Cl2+2e-=2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com