
5.函数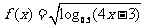 的定义域是
的定义域是
A.
{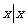
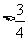 } B. {
} B. {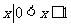 } C. {
} C. { } D. {
} D. {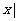
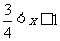 }
}
4.下列函数:①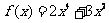 ,②
,②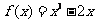 ,③
,③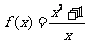 ,④
,④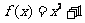 [来
[来
其中是偶函数的个数有
A . 1 B. 2 C. 3 D. 4
3.函数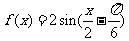 的最小正周期是
的最小正周期是
A.  B. 2
B. 2 C. 4
C. 4 D.
D. 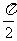
2.计算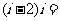
A. 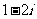 B.
B. 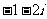 C.
C. 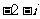 D.
D. 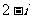
1.集合A={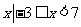 },B={
},B={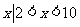 },则
},则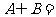
A.
{ } B. {
} B. { } C. {
} C. {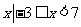 } D. {
} D. {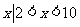 }
}
20.(每空2分,共14分)有机化合物A~H的转换关系如下所示:
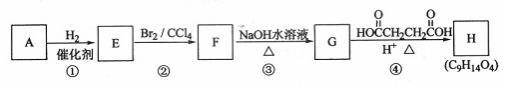
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,1molA完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是 ;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是 ;③的反应类型是 ;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B的一个可能的结构简式 。
19.(每空2分,共14分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
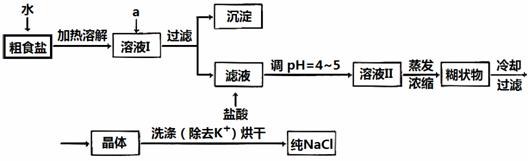
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
 (2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪 器除天平、药匙、玻璃棒外还有
(填仪器名称)。
器除天平、药匙、玻璃棒外还有
(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
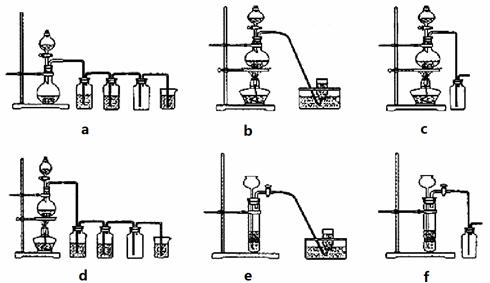
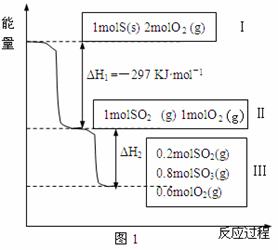
17.(每空2分,共14分)在右图中,甲烧杯中盛有CuSO4溶液,乙烧杯中盛有饱和NaCl溶液,A、B、C、D均为石墨电极,如果电解过程中共有0.04mol电子通过。
(1)甲烧杯中 极上最多可析出铜 g, 极上析出 气 mL(标准状况);
(2)在乙烧杯中滴入酚酞试液, 极附近变红,在乙烧杯中最终得到 溶液。
 18.(每空2分,共10分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:2 SO2 (g)+O2(g)
18.(每空2分,共10分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:2 SO2 (g)+O2(g)  2SO3(g) △H=-196.6 KJ·mol-1)
2SO3(g) △H=-196.6 KJ·mol-1)
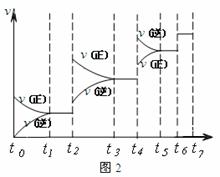
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )比图1所示情况增大的有______。
A.升高温度; B.充入He气
C.再充入1molSO2 (g)和1molO 2 (g) D.使用催化剂
(3)恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
(4)某SO2 (g)和O 2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率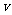 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡移动的条件可能是
;图中表示平衡混合物中SO3的含量最高的一段时间是
。
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡移动的条件可能是
;图中表示平衡混合物中SO3的含量最高的一段时间是
。
16.一定条件下,在某密闭容器中,有下列可逆反应:
 2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中正确的是
2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中正确的是
A.该反应的正反应为吸热反应
B.若升高温度,平衡向正反应的方向移动
C.当各物质浓度不再变化时,反应达到平衡状态
D.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动
第Ⅱ卷 非选择题(52分)
15.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
① |
硫酸溶液中加入Ba(OH)2溶液 |
Ba2++SO42-=BaSO4↓ |
正确 |
|
② |
氧化铝与NaOH溶液反应 |
2Al3++3O2-+2OH-= 2AlO+H2O |
错误,Al2O3不应写成离子形式 |
|
③ |
铁和稀硝酸反应 |
Fe+2H+= H2↑+Fe2+ |
正确 |
|
④ |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
A.只有② B.①③ C.②④ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com