
18.(浙江九所重点中学高三年级调研考试))现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
⑴计算这包铝热剂中铝的质量和氧化铁的质量。
⑵计算实验②产生气体的体积(标准状况)。
答案.⑴实验①中用去n(NaOH)=100 mL×(2.0 mol·L-1-1.0 mol·L-1)=0.1 mol
(1分)
无论是Al还是Al2O3,与NaOH溶液反应后都生成NaAlO2,铝热剂中
n(Al)=n(NaOH)×2=0.2 mol, m(Al)=5.4 g (2分,算出2.7 g给1分)
实验②所得溶液中,根据“电荷守恒”有n(H+)+2×n(Fe2+)+3×n(Al3+)=n(Cl-)
则n(Fe2+)=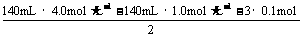 =0.06 mol (2分)
=0.06 mol (2分)
铝热剂中n(Fe2O3)=n(Fe2+)×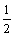 ×2=0.06 mol,m(Fe2O3)=9.6
g
×2=0.06 mol,m(Fe2O3)=9.6
g
(2分,算出4.8 g给1分)
⑵根据上述计算结果,反应2Al+Fe2O3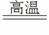 2Fe+Al2O3充分进行后所得固体混合物中含0.08 mol Al和0.12 mol Fe。
(1分)
2Fe+Al2O3充分进行后所得固体混合物中含0.08 mol Al和0.12 mol Fe。
(1分)
实验②中所得H2在标准状况下体积为
V(H2)=n(H2)×22.4 L·mol-1=[n(Al)×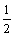 ×
×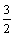 +n(Fe)×
+n(Fe)×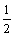 ]×22.4 L·mol-1=2.688 L
]×22.4 L·mol-1=2.688 L
(2分)
或者
取铝热剂的一半用“电子守恒”计算:
17.
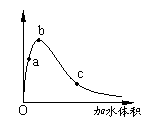 (浙江九所重点中学高三年级调研考试)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
(浙江九所重点中学高三年级调研考试)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
16.(浙江九所重点中学高三年级调研考试)已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
15.(杭州市2008年高三第一次高考科目教学质量检测化学) 将0.2mol·L-1HCOOH溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显酸性,下列关系式中正确的是
A.c(HCOOH)<c(HCOO-) B.c(Na+)>c(HCOO-)
C.c(HCOOH)-c(HCOO-)=c(OH-) D.c(HCOOH)+c(HCOO-)=0.2mol·L-1
15.(杭州市2008年高三第一次高考科目教学质量检测化学)某二元酸(H2A)在水中的电离方程式是:
H2A=H++HA-
HA- H++A2-
H++A2-
回答下列问题:
⑴请判断H2A是强电解质还是弱电解质? ▲ ,理由是 ▲ 。
⑵已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度应 ▲ 0.11 mol·L-1(填“<”,“>”或“=”),理由是: ▲
⑶Na2A溶液显 ▲ (填“酸性”,“中性”或“碱性”)。理由是 ▲ (用离子方程式表示)
⑷H2A溶液和Na2A溶液能否发生反应?能反应的写出离子方程式 ▲ 。
Da’an (1)强电解质;因为H2A的第一步电离是完全的。
(2)<;因H2A第一步电离产生的H+,抑制了HA-的电离。
(3)碱性;A2-+H2O HA-+OH-
HA-+OH-
(4)H++A2-==HA- (答“不反应”或离子方程式不写不给分)
(每空1分)
14.(杭州五校08高三第一次月考)已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示
|
|
a |
b |
c |
d |
e |
|
c |
↓ |
↓ |
╱ |
↑ |
- |
|
b |
↓ |
╱ |
↓ |
- |
- |
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“╱”表示实验未做。
则c 是
A. Ca(OH)2 B. Ca(HCO3)2 C. Ba(NO3)2 D. Na2CO3
13.(金丽衢十二校高三第一次联考化学模拟)以下说法中能证明无色透明液体是纯净水的是 ( D )
A.测得该液体pH=7 B.电解该液体得到氢气和氧气,且其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声 D.在l.0l×105Pa压强下测得沸点为373.15K
12、(金丽衢十二校高三第一次联考化学模拟)已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( D )
A、该温度高于25℃ B、水电离出来的c(H+)=1×10-10mol·L-1
C、c(H+)=c(OH-)+c(SO42-) D、该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
10、(温州市十校联合体高三联考)下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Cu2+ S2- Br- ClO- B.K+ Ba2+ OH- I-
C.Na+ H+ Cl- NO3- D.Na+ Mg2+ Cl- SO42-
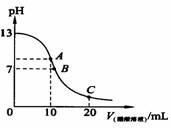 11、(温州市十校联合体高三联考)25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
11、(温州市十校联合体高三联考)25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
9.(浙江淳安县08届高三上学期三校联考)PH相同的盐酸和醋酸两种溶液中,它们的 ( d )
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com