
2.[江苏省前黄高级中学国际分校09届上学期综合练习三]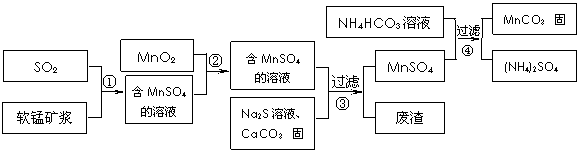 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42-+ 4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
,这样设计的目的和原理是 。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
答案..(1)小(1分),工业制备硫酸(1分)。
(2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O(2分)。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)(1分)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀(2分)。
(4)使MnCO3沉淀完全(2分)。MnCO3沉淀量少,NH4HCO3与酸反应(2分)。
(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(1分)
1.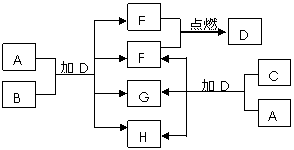 [江苏省前黄高级中学国际分校09届上学期综合练习三] (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
[江苏省前黄高级中学国际分校09届上学期综合练习三] (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
(1)写出E+F→D的化学反应方程式:
_________________________________。
(2)B的化学式___ ____,
A的电子式_____ ___。
(3)如上图所示,A与C两种固体混合后,加入
液体D,可能发生反应的化学方程式为:
______________________________________,________________________________________。
答案..(1)2H2+O2 == 2H2O (2)Al

(3)2Na2O2+ 2H2O = 4NaOH + O2↑ Al2 O3+ 2NaOH = 2NaAlO2+H2O
24.(浙江省开化中学08年1月高三模拟)现有常温下0.1 mol·L-1的纯碱溶液。
(1)下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
(2)纯碱溶液呈碱性,其原因是(用离子方程式表示) ,验证纯碱溶液呈碱性的实验方法(简述操作过程):
(3)纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)
(4)某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
选择答案填入表格内
23.(浙江省开化中学08年1月高三模拟)下列叙述正确的是
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH = 3的醋酸溶液,稀释至10倍后pH = 4
C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 1(忽略体积的变化)
D. Na2CO3溶液中:c(Na+) + c(H+) = c(HCO3-) +c(CO32-) + c(OH-)
22.(浙江省开化中学08年1月高三模拟)下列事实中,能证明NH3·H2O是弱电解质的是
A.常温时,稀氨水的导电性比稀NaOH溶液的导电性弱
B.常温时,等浓度等体积的氨水和盐酸混合,混合液pH小于7
C.1mol·L-1的氨水可以使酚酞试液变红色 D.液氨不导电
21.(浙江省开化中学08年1月高三模拟)二元酸H2A在水中发生电离:H2A H++HA-和HA-
H++HA-和HA- H++A2-,则下列物质的水溶液中存在的关系式不正确的是
H++A2-,则下列物质的水溶液中存在的关系式不正确的是
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)= c(A2-)+ c(HA-)
C.Na2A:c(Na+)> c(A2-)>c(OH-)>c(H+)
D.H2A:c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)
20、(浙江省开化中学08年1月高三模拟)物质的量浓度均为0.01mol·L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为
A.≥7 B.一定大于7 C.≤7 D.可能等于7
19、(浙江省开化中学08年1月高三模拟)25℃时,pH为9的Na2CO3溶液和pH为5的FeCl3溶液中,水的电离程度的大小
A.前者大 B.两者相等 C.后者大 D.无法确定
0.03 mol Fe2O3→0.06 mol Fe2+ 得电子0.06 mol
2n mol H+→n mol H2 得电子0.3 mol-0.06 mol=0.24 mol
算出n(H2)=0.12 mol (2分) V(H2)=2.688 L (1分)
0.1 mol Al→0.1 mol Al3+ 失电子0.3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com