
4.冶炼金属一般有下列方法:①焦炭法 ②水煤气(或
氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法;四种方法在工业上均有运用
(1)请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表中空格:
|
火烧孔雀石炼铜 |
湿法炼铜 |
铝热法炼铬 |
从光卤石中炼镁 |
|
|
|
|
|
火烧孔雀石炼铜所发生反应的化学方程式(写主要的两个: ;
。
(2)请再举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):② 、
③ 、
④ 。
(本题考查学生对金属冶炼方法的掌握情况及灵活运用知识的能力。答题时依据金属知识规律、注意反应条件和适用范围。)
新活题网站
3.(2001年上海高考题)下列物质中,不属于合金的是( )
A. 硬铝 B.黄铜 C.钢铁 D.水银
(该题考查学生对合金概念的掌握情况。答题时注意单质不属于合金范畴。)
2.(1993年全国高考题)a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种。已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为( )
A.Fe Cu Al Ag Mg
B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe
D.Mg Ag Al Cu Fe
(此题考查学生对金属活动顺序表的理解及对Al、Fe金属的特殊性质的记忆和理解。答题时按照题干要求,对照选项逐个分析筛选。)
1.下列关于金属元素特征的叙述正确的是( )
①金属性越强的元素相应的离子氧化性越弱;②金属元素只有金属性,没有非金属性;③价电子越多的金属原子金属性越强;④离子化合物中一定含金属元素;⑤晶体中可能只含阳离子,而不含阴离子
A.①②③ B.②③⑤ C.①⑤ D.全部
(本题考查学生对金属的通性理解和掌握情况。答题时要从金属元素原子及所形成的晶体结构特征方面考虑。)
3.金属的冶炼
(1)冶炼原理:Mn++ne-→M
(2)冶炼步骤:富集、冶炼、精炼
(3)冶炼方法:
a.电解法 化学性质很活泼的金属采用此法,金属活动顺序表中A1之前的金属。但要注意不能电解它们盐的水溶液,只能电解熔融盐。K一般不能电解熔融盐法,因钾易溶于熔融KCl,而一般用Na与KCl通过控制反应温度而得到。
b.还原法 化学性质较活泼的金属一般用还原剂还原法冶炼。常见的还原剂有碳、一氧化碳、氢气、铝粉、活泼金属等。用H2作还原剂一般制取纯度较高的金属;用铝作还原剂,常用于冶炼难熔的金属;用活泼金属如Na、Mg、Ca等作还原剂,主要冶炼某些稀有金属。
c.热分解法 金属活动顺序表中位于氢后面的金属因它们的氧化物受热易分解,常采用此法冶炼。
典型题点击
2.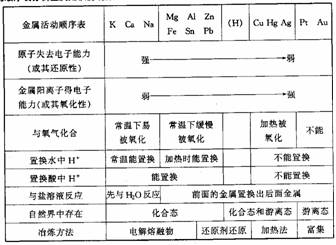 根据金属活动顺序表分析金属知识的规律
根据金属活动顺序表分析金属知识的规律
1.金属概论
(1)金属元素在周期表中的位置:周期表中除22种非金属元素外,其余皆为金属。分布2-7的前半周期,从族来看,分布在ⅠA、ⅡA、ⅢA的所有元素(除H、B外),ⅣA至ⅦA的部分元素以及所有的过渡元素。
(2)原子结构特征:原子最外层电子数较少,一般少于4个,与同周期非金属元素原子半径相比,金属元素原子半径较大,在反应中容易失去电子形成阳离子,表现还原性。
(3)存在形态:少数化学性质不活泼的金属,在自然界中以游离态存在,如Au、Pt及少量Ag、Cu。化学性质活泼的金属在自然界中总是以化合态存在。
(4)金属的物理性质:金属单质形成的晶体都是金属晶体(Hg常温下为液态)。在晶体中存在金属阳离子和自由电子,这一共同结构使金属有很多共同的物理性质,如金属光泽、导电性、导热性、延展性。而金属阳离子与自由电子的作用强弱,又决定了金属的硬度和熔、沸点高低,表现在同周期或同主族的金属元素所呈现的递变规律。
(5)合金:合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。合金的硬度一般比它的各成分金属大,熔点一般比它的各成分金属低。
13.(1)AlN+NaOH+H2O=NaAlO2+NH3↑
(2)n(AlN)=n(NH3)=3.36L/22.4L·mol-1=0.15mol
所以AlN的质量分数为
(3)n(O2)=2.016L/22.4L·mol-1=0.09mol
充分反应后所得气体的式量为1.34×22.4=30
O2、CO2的式量都大于30,则必含有CO,所得气体为CO、CO2混合气体。设物质的量分别为a、b,有:
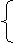 a+2b=0.09×2
a+2b=0.09×2
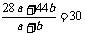 解得:a=0.14mol b=0.02mol
解得:a=0.14mol b=0.02mol
m(C)=(0.14mol+0.02mol)×12g/mol=1.92g。
12. (1)8Al+3 Fe3O4 4A12O3+9Fe;
(1)8Al+3 Fe3O4 4A12O3+9Fe;
(2)AlCl3+Na3P AlP+3NaCl;
(3)纳米粒子直径很小,表面积很大,具有极高的反应活性,在空气中极易被氧化,所以必须在真空容器中或惰性气氛中进行反应。
讲析: M单质能与Fe3O4发生置换反应并放出大量的热,则M单质应比Fe的金属性强,联系到Al与Fe2O3的铝热反应,可知M为Al。再根据元素周期表中原子序数为奇数的元素所处的族数为奇数这一规律,可推知其他元素为Na、P、Cl。再根据化合物X和化合物Y反应必然是互相交换成分这一规律和纳米粒子是第ⅢA-VA族元素组成的二元化合物这一条件可确定X为A1C13,Y为Na3P,纳米粒子为AlP。
11.(1)K2O·2UO3·V2O5·3H2O
(2)H2C2O4;0.51g
 讲析:由钒的原子序数是23,且钾钒铀矿中的钒原于最外层已达8电子稳定结构,知钒原子价电子数为5,在钾钒铀矿中钒显+5价。
讲析:由钒的原子序数是23,且钾钒铀矿中的钒原于最外层已达8电子稳定结构,知钒原子价电子数为5,在钾钒铀矿中钒显+5价。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com