
13.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 ;
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应)。该样品中含杂质炭 g。
第33课时 (A卷)答案与讲析
典型题点击
12.纳米材料是指由极细晶粒组成,纳米粒子是指直径为1-100nm的超细粒子。纳米材料在催化、光学、磁性力学等方面具有许多奇异的性能。有一种第ⅢA-VA族元素的二元化合物纳米粒子,由元素M和元素A组成。制备这种纳米粒子的方法是:在真空的容器中用电阻丝加热,首先发生M的单质与Fe3O4粉末的置换反应,利用该反应放出的热引发化合物X与化合物Y的反应,从而制得纳米粒子。巳知:X由元素M和元素B组成,Y由元素N和元素A组成。M、N、A、B均为同一短周期元素,且原于序数均为奇数。试回答:
(1)M和Fe3O4发生反应的化学方程式为:
(2)制取这种纳米粒子的化学反应方程式为:
(3)用这种方法制取纳米粒子都必须在真空的容器中或惰性气氛中进行,其原因是:
。
11.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中。钾钒铀矿中的钒原于是最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为 ;
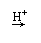 (2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
VO2++H2C2O4 VO++CO2+H2O(未配平)
其中的还原剂是 。若消耗0.9mol草酸,所对应钒元素的质量是 g。
10.工业上常用Na制备钛、锆、铌、钽等。如制钛,常用如下反应步骤;
(1)用90%浓H2SO4溶解钛铁矿(FeTiO3),反应式为:FeTiO3+3 H2SO4=FeSO4+Ti(SO4)2 +3H2O。
在除去不溶性杂质后,结晶析出FeSO4·7H2O时,为保持较高的酸度不能加水,其原因可能是
A.防止Fe2+被氧化
B.防止Ti(SO4)2水解
C.减少FeSO4·7H2O的溶解量
D.减少Ti(SO4)2的溶解量
(2)在除去杂质后,又需加大量水稀释以降低酸度,同时加热以生成TiO(OH)2沉淀,过滤,将TiO(OH)2加热分解即得钛白粉(TiO2)。除杂后加水稀释和加热的目的是
。
(3)在高温HCl气流中,TiO2可转化为TiCl4,反应方程式为: 。
(4)将TiCl4与Na共熔即可得Ti,反应式为
,若用TiCl4溶液与Na反应制Ti,不能达到预期目的,原因是
。
9.已知有关物质的熔沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点/℃ |
2852 |
2072 |
714 |
190(2.5×105Pa) |
|
沸点/℃ |
3600 |
2982 |
1412 |
182.7 |
请参考上述数据回答下列问题:
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁?理由是
。
为什么不用电解AlCl3的方法生产铝?理由是
。
8.现用一包可能由镁、铝、铁、铜、银几种金属组成的混合物进行如下实验:
(1)该混合物和过量的金属钾一起投入足量的水里立即有气体产生,反应停止后发现有少量残留固体。
(2)向上述固、液混合物逐滴加入盐酸,发现有白色沉淀产生,当盐酸滴加至过量时,沉淀部分消失伴有气体逸出,这时溶液显浅绿色。
(3)向(2)所得固、液混合物中加入足量稀硝酸,加热,发现残留固体溶解,最终得到澄清的溶液。
问:(1)上述混合物中一定存在的金属是 ,一定不存在的金属是 ,可能存在的金属是 。
(2)写出上述实验过程中所有肯定发生的化学方程式。
7.将5 g某金属加入100mL4mol·L-1的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是( )
A.铝 B.锌 C.铁 D.镁
6.将ag锌粉、A1粉、Mg粉的混合物与一定量的溶质质量分数为25%的稀硫酸恰好完全反应,加热蒸发水分后得固体bg(不含结晶水),则反应生成的H2质量是( )
A.(b-a)g B.(a-b)g
C.(b-a)/48g D.无法计算
5.当燃烧镁和某金属组成的合金时,所形成的氧化物的质量为反应前合金质量的2倍,则另一金属可能是( )
A.铜 B.铍 C.钠 D.铝
4.所谓合金,就是不同种金属(包括一些非金属)在熔化状态下形成的一种熔合物或冷却后的固体,如下表中金属最难与表中其他金属形成二元合金的元素是( )
|
|
Fe |
Cu |
Ag |
Au |
W |
|
熔点/℃ |
1535 |
1083 |
960.8 |
1063 |
3380 |
|
沸点/℃ |
3000 |
2595 |
2212 |
2707 |
5627 |
A.Zn B.Fe C.W D.Ag
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com