
8.(08年广东化学·7)某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是D
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
答案:D
解析:1.显然正确;2.沼气属于可再生资源。水煤气由炽热的煤同水蒸气反应制得,而煤为不再生资源,所以水煤气为不可再生资源,故错误; 3.冰为固态水,干冰为固态CO2,均为纯净物和化合物,正确; 4.显然正确。 5.盐酸和食醋为混合物,不是化合物,错误; 6.纯碱为Na2CO3不是碱,错误; 7.豆浆和雾都能发生丁达尔现象,均属于胶体,正确。综上所述,选D。
7.(08年宁夏理综·7)图标 所警示的是
A.当心火灾--氧化物 B.当心火灾--易燃物质
C.当心爆炸--自然物质 D.当心爆炸--爆炸性物质
答案:B
解析:本题考查对常见图标的识别的知识。根据图标可以判断应当为“当心火灾”,其对应的物质是“易燃物质”,因此答案为B。
6.(2007海南·1)下列物质中,不含有硅酸盐的是( )
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
答案:B
考点:本题考查了常见物质成份的辨别。
解析:水玻璃是硅酸钠的水溶液。黏土的成分主要是铝硅酸盐,常见的有高岭土。普通水泥主要成分有硅酸三钙、硅酸二钙、铝酸三钙。

5.(07年广东化学·19)下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
答案:BD
解析:纯碱不是碱、Mg、Al、Cu因活泼性不同冶炼方法分别是:电解法、电解法、热还原法。
4.(07年广东理基·31)从海水可获得的在常温下为液体的单质是
A.Mg B.K C.Br2 D.I2
答案:C
解析:单质溴是唯一的常温下为液态的非金属单质。
3.(07年广东理基·30)污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有
A.①②③ B.①②④ C.②③④ D.①②③④
答案:A
解析:过滤属于物理方法。
2.(07年广东理基·20)下列说法正确的是
A.可用丁达尔现象区分溶液与胶体 B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物 D.CuSO4·5H2O是一种混合物
答案:A
解析:生石灰与水混合时发生了CaO+H2O=Ca(OH)2的化学反应,故B选项错误;O3为单质不是化合物,而CuSO4·5H2O是一种化合物,不是混合物,故C、D选项均错误。
1.(07年广东文基·63)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
答案:A
解析:四个学校中的污水处理方法只有A选项中过滤是物理变化,其余的三种处理方法均是化学变化。
5.常见的22个重要分类归纳
(1)物质的变化的分类:是否生成新物质为标准,分为:物理变化和化学变化。
①.物理变化:没有生成新物质的变化,例如:物质的三态变化、某些混合物的分离操作、某些元素的鉴别。
例1:物质的三态变化:冰熔化、水蒸发、汽油挥发、氯气液化、溴的挥发、碘的升华。
例2:混合物的分离操作:分馏、蒸馏、萃取、分液、渗析、过滤。
例3:元素的鉴别:焰色反应鉴别碱金属或碱土金属。
②.化学变化:生成新物质的变化,例如:风化、钝化、煤的气化和液化、石油的裂化、油脂的硬化等。
例1:碳酸钠晶体(Na2CO3 ·10H2O)的风化成碳酸钠粉末。
例2:铁、铝的钝化:铁铝在常温下遇到冷的浓硫酸或浓硝酸反应生成致密的氧化物薄膜从而阻止继续反应的现象。
例3:煤的干馏、气化和液化:将煤隔绝空气加强热使之分解的过程叫煤的干馏;红热的煤炭和水蒸气反应生成氢气和一氧化碳的反应叫煤的气化;将一氧化碳和氢气化合成甲醇的反应叫煤的液化。
例4:石油的裂化和裂解:在一定条件下,大分子烷烃分解生成小分子烷烃和小分子烯烃的过程叫石油的裂化,裂解是深度裂化。
例5:油脂的硬化:不饱和的高级脂肪酸甘油脂与氢气加成生成饱和高级脂肪酸甘油脂的过程。
(2).能源分类(交叉分类法):
①.不可再生能源(化石能源:煤、石油、天然气)和可再生能源(沼气);
②.一次能源和二次能源:
ⅰ、一次能源:直接从自然界取得的能源,如:流水、风力、原煤、石油、天然气、天然铀矿等;
ⅱ、一次能源经过加工、转换得到的能源,如:电力、蒸汽等;电能是现代社会应用最广泛、使用最方便、污染最小的一种二次能源。
(3).新能源分类:可再生能源(沼气)和清洁能源。
(4).清洁能源分类:太阳能、氢能、核能、生物质能、地壳地表能(低热等地下能、潮汐等海洋能、风能等地面能。
(5).既能跟强酸溶液反应,又能跟强碱反应的溶液的物质有: Al或Zn 、Al2O3或ZnO 、Al(OH)3 或Zn(OH)2、(NH4)2CO3 等弱酸的铵盐、NaHCO3 等多元弱酸的酸式盐、H2N-CH2COOH等氨基酸。
(6).盐类水溶液酸碱性判断方法:强酸强碱盐不水解呈中性,强酸弱碱盐水解呈酸性,强碱弱酸盐水解呈碱性,弱酸弱碱盐水解谁强显谁性,醋酸铵溶液呈中性,其他溶液以醋酸铵为标准参照判断,例如酸性HF>CH3COOH ,NH4F溶液呈酸性,HCN<CH3COOH,NH4CN溶液呈碱性。
(7).常见的6种强酸:HCl 、HBr 、HI 、HNO3 、H2SO4 、HClO4
(8).常见的4种强碱:KOH 、NaOH 、Ba(OH)2 、Ca(OH)2 。
(9).弱酸的酸式盐分类:呈酸性的酸式盐(NaHC2O4 、NaH2PO4 、NaHSO3)和呈碱性的酸式盐(NaHCO3 、Na2HPO4 、NaHS)。
(10).常见化学危险品的分类及其对应的图标辨认方法
①.第一类:爆炸品-------图案为辐射状,与电影中的手榴弹爆炸情形一样
②.第二类~第五类:可燃性气体、助燃性物质都有火焰,其中氧化剂的火焰下方带有氧元素的“O”标记。
③.第六类:有毒品,为死人头盖骨和交叉的骨棒。
④.第七类:放射性物品,形状像电扇的叶轮。
⑤.第八类:腐蚀品,图案为使管内液体流出腐蚀桌面或手。
(11).酸碱盐根据溶解性分为可溶物和不溶物。
酸碱盐溶解性口诀:
①.钾钠钡铵碱都溶,含义:可溶性碱有:KOH、NaOH、Ba(OH)2、NH3 ·H2O都溶于水,澄清石灰水溶。
②.硝酸盐类也相同,含义:硝酸盐都溶于水,象可溶性碱一样溶于水。
③.氯化银汞要沉淀,含义:AgCl 、Hg2Cl2不溶于水。
④.硫酸钡铅还不溶,含义:BaSO4 、PbSO4也不溶于水。
⑤.碳磷硅酸亚硫酸,钾钠铵盐溶水中,含义:碳酸盐、磷酸盐、硅酸盐、亚硫酸盐中只溶解对应的钾盐、钠盐、铵盐。
⑥.硫化钡镁钾钠铵,定要溶解要记全,含义:硫化物质溶解BaS 、MgS 、K2S 、Na2S 、(NH4)2S。
(12).酸碱指示剂分类:甲基橙、甲基红、石蕊、酚酞。
①.甲基橙:溶液pH<3.1时,呈红色;溶液3.1<pH<4.4时,呈橙色;溶液pH>4.4时,呈黄色
说明:溶液4.4<pH<7(酸性)时,呈黄色;溶液pH=7(中性)时,呈黄色,溶液pH>7(碱性)时呈黄色,甲基橙可以做强酸溶液和强碱溶液滴定时的指示剂。
②.石蕊:溶液pH<5时,呈红色;溶液5<pH<8时,呈紫色;溶液pH>8时,呈蓝色
说明:溶液5<pH<7(酸性)时,呈紫色;溶液pH=7(中性)时,呈紫色,溶液7<pH<8(碱性)时呈紫色,石蕊不能做强酸溶液和强碱溶液滴定时的指示剂。
③.酚酞:溶液pH<8.2时,呈无色;溶液8.2<pH<10时,呈浅红色;溶液pH>10时,呈红色
说明:溶液pH<7(酸性)时,呈无色;溶液pH=7(中性)时,呈无色,溶液7<pH<8.2(碱性)时呈无色,酚酞可以做强酸溶液和强碱溶液滴定时的指示剂。
(13).同分异构体形成原因分类:类别异构、官能团位置异构和碳干异构、平面异构。
(14).常见的类别异构有:①烯烃和环烷烃;②炔烃和二烯烃;③醇和醚;④醛和酮;⑤羧酸、酯、羟基醛、羟基酮;⑥葡萄糖和果糖;⑦麦芽糖和蔗糖;⑧氨基酸和硝基烷。
(15).干燥剂分类:酸性干燥剂、中性干燥剂、碱性干燥剂。
①.酸性干燥剂分类:液态干燥剂:浓硫酸,固态干燥剂:五氧化二磷、硫酸铜、硅胶。
②.碱性干燥剂分类:碱石灰、氢氧化钠。
③.中性干燥剂:氯化钙。
(16).干燥剂不能干燥的气体:
①.浓硫酸不能干燥碱性气体(NH3)和还原性气体(H2S 、HI、HBr)。
②.碱石灰不能干燥酸性气体:Cl2 、HCl 、HI、HBr、H2S 、SO2 、NO2 、CO2 。
③.既能用浓硫酸,又能用碱石灰干燥的湿气体是:非金属单质气体(H2 、N2 、O2)、非金属氧化物气体(CO)和非金属氢化物气体(CH4 、C2H4 、C2H2)。
④.既不能用浓硫酸,也不能用碱石灰干燥的湿气体是:H2S 、HI、HBr。
⑤.氯化钙不能干燥的气体:氨气因为形成络合物CaCl2 ·8NH3的缘故。
(17).高分子化合物分类:天然高分子化合物(纤维素、蛋白质、蚕丝、橡胶、淀粉)和人工合成高分子化合物(各种塑料,合成橡胶,合成纤维、涂料与粘接剂)。
(18).聚合反应的分类:加聚反应和缩聚反应。
①.由一种或多种单体相互加成,结合为高分子化合物的反应,叫做加聚反应。在该反应过程中没有产生其他副产物,生成的聚合物的化学组成与单体的基本相同。
②.缩聚反应是指由一种或多种单体互相缩合生成高聚物,同时析出其他低分子化合物(如水、氨、醇、卤化氢等)的反应。缩聚反应生成的高聚物的化学组成与单体的不同
(19).气体的收集方法分类:
①.能用排水法收集的气体类别有:不溶于水或微溶于水的气体:H2 、N2 、O2 、CH4 、C2H4 、C2H2、CO等。
②.用排饱和溶液法收集的气体类别有:氯气(饱和食盐水)、二氧化碳(饱和碳酸氢钠溶液)、二氧化硫(饱和的亚硫酸氢钠溶液)。
③.向上排空气法收集的气体有:相对分子质量大于等于32的气体:CO2 、NO2 、H2S 、SO2 、O2、Cl2 、HCl。
④.向下排空气法收集的气体有:相对分子质量小于等于26的气体:H2 、CH4 、C2H2、NH3 。
⑤.不能用排空气法收集的气体有:CO 、C2H4 、N2 、NO。
⑥.不能用排水法收集的气体有:HCl 、NH3 。
(20).能用启普发生器制备的气体:二氧化碳、硫化氢、氢气
说明:启普发生器制备气体的原则:①块状不溶于水的固体和液体反应,②反应不需要加热或者反应本身不放热,③生成的气体不溶于水或微溶于水。
(21).质子数和电子数都相同的微粒分类:离子类和分子类。
①.离子类又分为阳离子和阴离子:①.阳离子:Na+ 、NH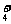 、H3O+
;②阴离子:F- 、OH- 、 NH
、H3O+
;②阴离子:F- 、OH- 、 NH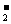 、BH
、BH ;③阴离子:Cl- 、HS- ;④阳离子:Ca2+ 、N2H
;③阴离子:Cl- 、HS- ;④阳离子:Ca2+ 、N2H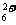 。
。
②.中性分子又分为简单分子和复杂分子或10电子分子和18电子分子:①.10电子的中性分子:Ne、HF 、H2O 、NH3 、CH4 ;②.18电子的中性简单分子:Ar;HCl 、H2S 、PH3 、SiH4 ;③.18电子的中性复杂分子:F2 、H2O2 、 N2H4 、 C2H6 ,CH3F 、CH3OH 、CH3NH2 。
(22).溶液褪色分类:
①.二氧化硫使品红溶液褪色是化学褪色中的化合褪色(加成褪色)。
②.二氧化硫使酸性高锰酸钾溶液褪色,是高锰酸钾被还原褪色。
③.活性炭是红钢笔水褪色,是物理褪色,是吸附褪色。
④.氯水使红色布条褪色,是化学褪色,使次氯酸氧化有色布条褪色。
-----------------------------------------------------------------------------------------------------------------------------------------
例题1:(1953年全国高考试题第1题)(10分)空气是混合物,还是化合物?用两个理由说明.
答案:混合物(2分);理由:①成份不固定,②氧氮不化合,③溶于水的空气的氧氮比例与空气中不同,
④液化空气蒸发时,氮先出。
详解:①空气的主要成分是氮气和氧气,还含有少量的二氧化碳、水蒸气以及稀有气体等,并随各地空气污染指数不同含有不同的大气污染物。②混合物是由不同物质组成的,没有固定的熔沸点;化合物是纯净物,有固定不变的组成,有固定的熔沸点。③分离液态空气时沸点低的氮气先出来,氧气后出来;说明空气的沸点不同是混合物,同时也说明空气是由多种物质组成的是混合物。
例2:(1956年全国高考题第4题)加一种什么试剂并根据什么现象,来鉴别下列各对物质(不要求写反应式)
(1)氯化钠和氯化铵;(2)氮气和二氧化碳;(3)硫酸钠和碳酸钠;
(4)氯化铁和氯化亚铁;(5)乙烯和乙烷
[答案]
详解:
(1)共性归纳:氯化钠和氯化铵都是盐酸盐;氮气和二氧化碳都是空气的成分,通常情况下都不支持燃烧;硫酸钠和碳酸钠都是可溶性钠盐;氯化铁和氯化亚铁都是铁元素的盐酸盐;乙烯和乙烷都是含有两个碳原子的烃分子。
(2)物质的鉴别根据物理性质鉴别:颜色、气味、密度、溶解性、熔沸点、硬度、特性等。本题中根据焰色反应可以鉴别氯化钠和氯化铵,根据溶解性鉴别氮气和二氧化碳,根据溶液颜色鉴别氯化铁溶液(黄色)和氯化亚铁溶液(浅绿色)。
(3)物质的鉴别根据化学性质鉴别:酸碱性、氧化还原性、络合性、热稳定性、饱和性和不饱和性等。
①.酸碱性:可以鉴别氯化钠和氯化铵、硫酸钠和碳酸钠。
方法:将固体溶于水,用pH 试纸检验,pH=7的溶液是氯化钠溶液和硫酸钠溶液,pH<7的是氯化铵溶液,pH>7的是碳酸钠溶液。
说明:强酸强碱盐不水解溶液呈中性,强酸弱碱盐水解溶液呈酸性,例如:氯化铵(pH<7);强碱弱酸盐水解溶液呈碱性,例如:碳酸钠(pH>7)。
②.加酸可以鉴别硫酸钠和碳酸钠。
方法:在固体中加入盐酸,有气泡产生的是碳酸钠。
③.加碱可以鉴别的是氯化钠和氯化铵、氮气和二氧化碳、氯化铁和氯化亚铁。
方法:在固体中加入强碱混合研磨,有刺激性气味产生是氯化铵;将气体通入澄清石灰水,石灰水变浑浊的是二氧化碳气体;将固体溶于水再加入碱溶液,产生白色沉淀变成灰绿色最终变成红褐色的是氯化亚铁溶液,直接产生红褐色沉淀的是氯化铁溶液。
④.氧化还原性:鉴别氯化铁和氯化亚铁
ⅰ、能溶解铜粉的是氯化铁溶液:2FeCl3+Cu=2FeCl2+CuCl2
ⅱ、能使润湿的碘化钾淀粉试纸变蓝色的是氯化铁溶液:2FeCl3+2KI=2FeCl2+I2+2KCl ,碘遇淀粉变蓝色。
⑤.络合性:鉴别氯化铁和氯化亚铁。
方法:将固体溶于水,加入硫氰化钾溶液,溶液呈红色的是鉴别氯化铁溶液。
⑥.热稳定性:鉴别氯化钠和氯化铵。
方法:将固体置于试管中加热,固体质量不变的是氯化纳,质量减少以至消失的是氯化铵。
⑦.饱和性和不饱和性:鉴别乙烯和乙烷
方法1:加成反应鉴别法:使溴水(黄色或橙色)褪色的是乙烯。
方法2:氧化反应鉴别法:使酸性高锰酸钾溶液(紫色)褪色的是乙烯。
例3:[1964年全国高考试题第3题(2)]有一种分子式为C3H6O2的化合物,跟钠不起反应,此化合物经水解后生成甲和乙两种化合物;它们都跟钠起反应而放出氢气。甲既能跟氢氧化钠溶液起反应,又能起银镜反应,但乙不能。原化合物是 它的结构式是: ;说明理由:
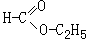 答案:甲酸乙酯 (2分);(或HCOOC2H5) (1分);跟钠不起放出氢气的反应,表
答案:甲酸乙酯 (2分);(或HCOOC2H5) (1分);跟钠不起放出氢气的反应,表
明无羟基或羧基(1分);水解后的两种化合物都能跟钠起反应放出氢气,可能是醇或酸(1分);甲化合物能跟氢氧化钠起反应,应是一个酸(1分);简单羧酸中只有甲酸能起银镜反应.(1分);乙化合物不跟氢氧化钠起反应,因此是一个醇,根据分子式中碳原子的数目,应为乙醇(1分);酯类水解后得到酸和醇(1分)。因此原化合物是甲酸乙酯。
详解: 分子式为C3H6O2的化合物同分异构体分三类:羟基酮类、羟基醛类、羧酸类、酯类。
①.羟基酮类:1-羟基丙酮,可以与钠反应产生氢气,但是不能水解,不符合题意。
②.羟基醛类:2-羟基丙醛、3-羟基丙醛,可以与钠反应产生氢气,但是不能水解,不符合题意。
③.羧酸类:丙酸,可以与钠反应产生氢气,但是不能水解,不符合题意。
④.酯类:甲酸乙酯和乙酸甲酯都不跟钠反应,水解后的产物(酸和醇)都可以与钠反应产生氢气,酯类水解的产物中只有酸能与碱溶液反应,而在羧酸中只有甲酸能发生银镜反应,所以该化合物是甲酸乙酯。
-----------------------------------------------------------------------------------------------------------------------------------------
07~09年《物质的分类》高考题15道详解
4.交叉分类法:为了弥补一种分类方法的局限性,人们在认识事物时从不同的角度设定不同的标准对同一事物进行认识,这种方法叫交叉分类法。
例1:化合物分类:角度不同分类结果不同(交叉分类法)
①.是否含有碳元素:无机化合物和有机化合物;②.化学键类型:共价化合物和离子化合物;③.是否导电:电解质和非电解质。
说明:蔗糖属于有机化合物、共价化合物、非电解质,二氧化碳属于无机化合物、共价化合物、非电解质。
例2: 氧化物分类:角度不同分类结果不同(交叉分类法)
①.根据成盐情况分类:成盐氧化物和不成盐氧化物,②.成盐氧化物分为酸性氧化物和碱性氧化物,③.根据氧化物中的非氧元素类别分为金属氧化物和非金属氧化物。
说明:一氧化碳属于非金属氧化物、不成盐氧化物;二氧化碳属于非金属氧化物、成盐氧化物、酸性氧化物;七氧化二锰属于金属氧化物、成盐氧化物、酸性氧化物;氧化钠属于金属氧化物、成盐氧化物、碱性氧化物;氧化铝属于金属氧化物、成盐氧化物、两性氧化物。
例3:酸的分类:角度不同分类结果不同(交叉分类法)
①组成是否含有氧元素分类:含氧酸(HNO3 、H2SO4 、H2CO3)和无氧酸(HCl 、H2S 、HI)。
②电离出氢离子的难易分类:强酸(HNO3 、H2SO4 、HClO4 、HCl 、HBr、HI)和弱酸(H2CO3 、H2S 、HF 、HClO)、H2C2O4。
③根据电离出氢离子的多少分类:一元酸(HCl 、HNO3)、二元酸(H2CO3 、H2SO4、H2C2O4)、三元酸(H3PO4)
④根据溶解性分类:可溶性酸(H2CO3)和不溶性酸(H2SiO3)
⑤根据稳定性分类:不稳定的酸(H2CO3 、H2SO3 、H2SiO3 、HNO3 、HClO)、稳定的酸(H2SO4)。
⑥根据氧化性和还原性分类:氧化性酸(HNO3 、HClO 、浓H2SO4)、还原性酸(H2SO3 、H2S 、HI)。
⑦根据挥发性难易分类:难挥发性酸(H2SO4 、H3PO4)、挥发性酸(HF 、HCl 、HBr、HI、 HNO3)。
⑧根据酸根的构成元素分类:无机酸(H2CO3)、有机酸(CH3COOH)
说明:硝酸属于含氧酸、强酸、一元酸、可溶性酸、不稳定性酸、氧化性酸、挥发性酸、无机酸;硫酸属于含氧酸、强酸、二元酸、可溶性酸、稳定性酸、浓硫酸是氧化性酸、难挥发性酸、无机酸;盐酸属于无氧酸、强酸、一元酸、可溶性酸、稳定性酸、还原性酸、挥发性酸、无机酸。
例4:碱的分类:角度不同分类结果不同(交叉分类法)
①根据电离出氢氧根离子的多少分类:一元碱、二元碱、三元碱。
一元碱:NaOH 、KOH 、NH3·H2O ;二元碱:Ba(OH)2 、Ca(OH)2 、Mg(OH)2 、Fe(OH)2 、Cu(OH)2 ;
三元碱:Al(OH)3 、Fe(OH)3
②电离出氢氧根离子的难易分类:强碱、弱碱。
强碱:NaOH 、KOH 、Ba(OH)2 、Ca(OH)2 ;
弱碱:NH3·H2O 、Mg(OH)2 、Al(OH)3 、Fe(OH)3 、Fe(OH)2 、Cu(OH)2
③根据氧化性和还原性分类:氧化性碱、还原性碱。
氧化性碱:与还原性强酸发生中和反应和氧化还原反应。例如:2Fe(OH)3+6HI=2FeI2+I2+6H2O
还原性碱:与氧化性强酸发生氧化还原反应和中和反应。例如:2Fe(OH)2+4H2SO4(浓)=Fe2(SO4)3+SO2 ↑+4H2O
④根据溶解性分类:可溶性碱、不溶性碱
可溶性碱:NH3·H2O、 NaOH 、KOH 、Ba(OH)2 、Ca(OH)2
不溶性碱:Mg(OH)2 、Al(OH)3 、Fe(OH)3 、Fe(OH)2 、Cu(OH)2
⑤根据稳定性分类:热不稳定的碱、稳定的碱。
稳定的碱:NaOH 、KOH 、Ba(OH)2 、Ca(OH)2
热不稳定的碱:NH3·H2O 、Mg(OH)2 、Al(OH)3 、Fe(OH)3 、Fe(OH)2 、Cu(OH)2
⑥根据挥发性难易分类:难挥发性碱、挥发性碱
挥发性碱:NH3·H2O
难挥发性碱: NaOH 、KOH 、Ba(OH)2 、Ca(OH)2 、Mg(OH)2 、Al(OH)3 、Fe(OH)3 、Fe(OH)2 、Cu(OH)2
说明:氨水属于一元碱、弱碱、可溶性碱、不稳定性碱、挥发性碱;氢氧化铝属于三元碱、弱碱、不溶性碱、两性碱、热不稳定性碱、难挥发性碱;氢氧化铁属于三元碱、弱碱、氧化性碱、不溶性碱、热不稳性碱、难挥发性碱;氢氧化亚铁属于二元碱、弱碱、不溶性碱、难挥发性碱、还原性碱,氢氧化钠属于一元碱、强碱、可溶性碱、稳定性碱、不挥发性碱。
例5:盐的分类:角度不同分类结果不同(交叉分类法)
①从盐的组成上分类;
按阳离子分类:钠盐(Na+),例如:氯化钠、碳酸钠、碳酸氢钠、硫酸钠、硫酸氢钠、六氟合铝酸钠。
按阴离子分类:碳酸盐(CO32-),可溶性碳酸盐有:碳酸钠、碳酸钾、碳酸铵。
②从阴阳离子的复杂程度分类:复盐、络盐、复杂的硅酸盐
Ⅰ.复盐:同一种酸根离子和不同种金属阳离子组成的盐,例如:明矾KAl(SO4)2 ·12H2O
Ⅱ.络盐:含有络离子的盐。
例如:阳离子[Fe(SCN)]2+是络离子的盐,Fe(SCN)Cl2 (名称:二氯化硫氰合铁)。
例如:阴离子[AlF6]3-是络离子的盐,NaAlF6(冰晶石,名称六氟合铝酸钠)
Ⅲ.复杂的硅酸盐:铝硅酸盐
例如:长石:KAlSi3O8 写成氧化物形式K2O·Al2O3 ·6SiO2
③从形成盐时的酸碱中和情况分类:酸式盐、正盐、碱式盐
Ⅰ.酸式盐根据溶液的酸碱性又可以分类:呈酸性的酸式盐和呈碱性的酸式盐
呈酸性的酸式盐:NaHSO4 、NaHSO3 、NaH2PO4 、NaHC2O4
呈碱性的酸式盐:NaHCO3 、Na2HPO4
Ⅱ.正盐根据溶液的酸碱性又可以分类:呈酸性的正盐、呈中性的正盐、呈碱性的正盐
呈酸性的正盐:强酸和弱碱中和所形成的盐,例如:氯化铵
呈中性的正盐:强酸和强碱中和所形成的盐,例如:氯化钠
呈碱性的正盐:弱酸和强碱中和所形成的盐,例如:碳酸钠
Ⅲ.碱式盐:Cu2(OH)2CO3
④从盐的溶解性上分类:可溶性盐、不溶性盐
可溶性盐:所有的硝酸盐、硫酸盐除钡铅,盐酸盐除去银亚汞,碳酸盐只溶钾钠铵。
不溶性盐:氯化银、硫酸钡、碳酸钙、碳酸钡等
⑤从盐的水溶液的颜色分类:无色的盐、有色的盐
无色的盐溶液:大多数盐溶液
有色的盐溶液:MnO4- ---紫色,Fe3+---黄色,Fe2+----浅绿色,Cu2+---蓝色
⑥从盐的热稳定上分类:热稳定性的盐、热不稳定性的盐
热稳定性的盐:受热不分解的盐:NaCl、Na2CO3 。
热不稳定性的盐:受热容易分解的盐:NaHCO3 、NH4Cl、银盐(AgNO3 、AgCl 、AgBr 、AgI)
说明:碳酸钠属于钠盐、碳酸盐、正盐、可溶性盐、无色盐、热稳定性盐。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com