
2、A、B、C、D四种元素,已知A原子核内只有一个质子,B原子的电子总数恰好与D原子最外层电子数相等,且D原子最外层电子数是其次外层电子数的3倍,又知A、B、C、D的原子序数依次增大。据此推知:
(1)A与D组成的化合物,其化学式可表示为_________。
(2)B与D组成的化合物中,属于极性分子的化学式为_________;属于非极性分子的结构式为_________。
(3)A与C组成的四核分子属于______分子。
解析:A原子核内只有一个质子,则A为氢元素。D原子最外层电子数是次外层电子数的3倍,其电子层结构为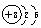 ,D为氧元素。B原子电子总数等于氧原子最外层电子数,B为碳元素。因为A、B、C、D的原子序数依次增大,所以C必为氮元素。A与D可组成H2O和H2O2两种化合物;B与D可形成CO和CO2两种化合物,其中CO2为非极性分子;A与C形成的化合物NH3为极性分子。
,D为氧元素。B原子电子总数等于氧原子最外层电子数,B为碳元素。因为A、B、C、D的原子序数依次增大,所以C必为氮元素。A与D可组成H2O和H2O2两种化合物;B与D可形成CO和CO2两种化合物,其中CO2为非极性分子;A与C形成的化合物NH3为极性分子。
答案:(1)H2O、H2O2 (2)CO O==C==O (3)极性
1、.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_______,该化合物由_______键形成。
(2)Na3N与盐酸反应生成_______种盐,其电子式分别是_______。
(3)Na3N与水的反应属于_______(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)_______(填“>”“=”“<”)r(N3-)。
答案:(1)Na+[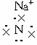 ]3-Na+ 离子
]3-Na+ 离子
(2)两
Na+[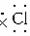 ∶]-和[H
∶]-和[H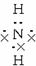 H]+[
H]+[ ∶]-
∶]-
(3)复分解 (4)<
3、分子间作用力与氢键比较
|
分 类 |
分子间作用力(范德瓦耳斯力) |
氢 键 |
|
概 念 |
物质分子之间存在的微弱相互作用(实质上也是静电作用) |
分子中与氢原子形成共价键的非金属原子,如果吸引电子的能力很强,原子半径又很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷。这样的分子之间,氢核与带部分负电荷的非金属原子相互吸引。这种静电作用就是氢键 |
|
存在范围 |
分子间 |
某些含氢化合物分子间(如HF、H2O、NH3) |
|
强度比较 |
比化学键弱得多 |
比化学键弱得多,比分子间作用力稍强 |
|
影响强度 的因素 |
随着分子极性和相对分子质量的增大而增大。组成和结构相似的物质,相对分子质量越大,分子间作用力越大 |
形成氢键的非金属原子,其吸引电子的能力越强、半径越小,则氢键越强 |
|
对物质性质的影响 |
影响物质的熔点、沸点、溶解度等物理性质。组成和结构相似的物质,随相对分子质量增大,分子间作用力增大,熔点、沸点升高。如熔点:F2<Cl2<Br2<I2,CF4<CCl4<CBr4<CI4 |
分子间氢键的形成,使物质的熔点、沸点升高,在水中的溶解度增大。如沸点:H2O>H2S,HF>HCl,NH3>PH3 |
典例剖析
[例1] (2004年全国理综四,8)下列分子有极性的是
A.CCl4 B.CO2 C.NH3 D.C6H6
[例2] (2004年全国理综三,14)下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.SF4
特别提示
高考化学试题中曾频频出现判断分子中各原子的最外层电子是否满足8电子稳定结构的题目。其简捷准确的判断方法是:
(1)分子中若含有氢元素,则氢原子不能满足最外层8电子稳定结构,但它满足K层为最外层2个电子的稳定结构。(Be原子最外层只有2个电子,在其化合物中最外层电子数不可能是8)
(2)分子中若不含有氢元素,则按下述方法逐一进行判断。若某元素化合价绝对值与其原子最外层电子数之和等于8,则该元素的原子最外层满足8电子稳定结构;否则将不满足。如CO2分子中,碳元素的化合价为+4,碳原子最外层电子数为4,二者之和为8,则碳原子满足最外层8电子稳定结构;氧元素化合价为-2(其绝对值为2)氧原子最外层电子数6,二者之和为8,则氧原子也满足最外层8电子稳定结构,故CO2分子中所有原子都满足最外层8电子结构。再如NO2分子中,氮元素化合价为+4,氮原子最外层电子数为5,二者之和为9,故氮原子不满足最外层8电子稳定结构。再如BF3分子中,硼元素化合价为+3,硼原子最外层电子数为3,二者之和为6,故硼原子也不满足最外层8电子稳定结构。
(3)常见的X2(卤素单质)、O2、N2等双原子单质分子中原子最外层为8电子稳定结构。
夯实基础
2、极性分子与非极性分子
(1)分子极性的判断
分子的极性由共价键的极性及分子的空间构型两方面共同决定:
①以极性键结合而形成的异核双原子分子都是极性分子,如HCl。
②以非极性键结合而形成的同核双原子分子都是非极性分子,如Cl2。
③以极性键结合而形成的多原子分子,既有极性分子,又有非极性分子,分子的空间构型均匀对称的是非极性分子。如AB2型的直线形分子CO2,AB3型的平面正三角锥形分子BF3,AB4型的正四面体结构分子CH4等。分子的空间构型不对称的多原子分子为极性分子。如V型的H2O,三角锥型的NH3,不规则四面体分子CH3Cl等。
④判断ABn型分子极性有一经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
(2)相似相溶原理
极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如碘易溶于苯中,白磷易溶于CS2中)。
1、化学键与物质类别规律
(1)只含非极性共价键的物质:同种非金属元素构成的单质,如I2、N2、P4、金刚石、晶体硅等。
(2)只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。如HCl、NH3、SiO2、CS2等。
(3)既有极性键又有非极性键的物质:如H2O2、C2H2、CH3CH3、C6H6(苯)等。
(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。
(5)既有离子键又有非极性键的物质,如Na2O2、Na2Sx、CaC2等。
(6)只有共价键,没有范德瓦耳斯力的物质--金刚石、单晶硅、SiO2、SiC。
(7)无化学键的物质--稀有气体。
2.分子的极性与共价键的极性有何关系?如何判断分子有无极性?
提示:极性分子中一定含有极性键,由极性键构成的分子不一定是极性分子。判断分子有无极性的方法是:首先看键是否有极性,然后再看各键的空间排列状况。键无极性,分子必无极性;键有极性,各键空间排列均匀,使键的极性相互抵消,分子无极性。各键空间排列不均匀,不能使键的极性相互抵消,分子有极性。
疑难突破
1.举例说明书写物质的电子式时应注意的问题有哪些?
提示:(1)阴离子和复杂阳离子(NH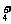 、CH
、CH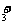 )要加括号,并注明所带电荷数。如:
)要加括号,并注明所带电荷数。如:
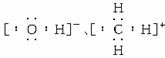 等。
等。
(2)要注意化学键中原子直接相邻的事实。如MgBr2的电子式: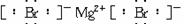 ,不能写作:Mg2+
,不能写作:Mg2+ 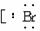 ∶]
∶]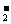 。
。
(3)要注意书写单质、化合物的电子式与单质、化合物形成过程电子式的差别。如CO2的电子式为∶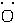 ∶∶C∶∶
∶∶C∶∶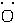 ∶,CO2形成过程的电子式为
∶,CO2形成过程的电子式为
∶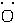 ∶+∶C∶+∶
∶+∶C∶+∶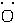 ∶
∶ ∶
∶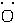 ∶∶C∶∶
∶∶C∶∶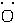 ∶
∶
(4)要熟练掌握一些重要物质的电子式的书写。如HClO:H∶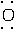 ∶
∶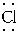 ∶;NaH:
∶;NaH:
Na+ [∶H]-;Na2O2:Na+
[∶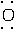 ∶
∶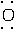 ∶]2-Na+;HCl:H∶
∶]2-Na+;HCl:H∶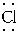 ∶;NH3:H∶
∶;NH3:H∶ ∶[NH4Cl:[H∶
∶[NH4Cl:[H∶ ∶H]+[∶
∶H]+[∶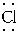 ∶]-。
∶]-。
2.极性分子与非极性分子
(1)下列关于分子的极性的说法,不正确的是( )
A.极性分子中可能含有非极性键 B.非极性分子中可能含有极性键
C.极性分子中不一定只含有极性键 D.非极性分子中只含有非极性键
思考讨论
1.离子键与共价键
(1)下列物质受热熔化时,不需要破坏化学键的是( )
A.食盐 B.纯碱 C.干冰 D金刚石
(2)下列五种物质中,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ;不存在化学键的是 (填序号)。
①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S
(3)用电子式表示下列物质的形成过程:①N2  ;
;
②PCl3 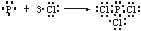 ;
;
③MgF2 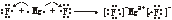 ;
;
④Na2O  ;
;
⑤H2O 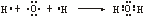 ;
;
⑥NaH  。
。
28.美国总统奥巴马今年1月执政后着手启动美国近70年来规模最大的医疗改革,目的是使每个美国人都能买得起医疗保险,享受良好的医疗福利来兑现“我为美国民众服务”承诺。但是推出的医改方案遭到了共和党人的冷遇,他们想在此次医改风波中看到了削弱民主党人声势的希望,来抬高自己在美国人心目中的地位。奥巴马敦促国会批准医改方案,但是参众两院迟迟就方案未达成一致意见,议员纷纷认为,政府应该努力听取反对的意见。此次改革将损害某些“利益集团”的利益,而这些“利益集团”正全力阻止国会通过医疗改革案,使得医改方案实施困难重重。
结合材料,运用《国家与国际组织》知识,分析说明奥巴马的医疗改革方案能否兑现“我为美国民众服务”的承诺。(14分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com