
22. (8分)一块碳素钢表面有一层薄薄的水膜,若这层水膜酸性很弱或显中性,则发生________腐蚀,其正极反应式为__________________,负极反应式为__________________,电池总反应式为________________________;若钢铁表面的水膜呈酸性,则此时钢铁发生____________腐蚀,正极的电极反应式为____________________,负极的电极反应式为_____________________,电池总反应式为______________。
(8分)一块碳素钢表面有一层薄薄的水膜,若这层水膜酸性很弱或显中性,则发生________腐蚀,其正极反应式为__________________,负极反应式为__________________,电池总反应式为________________________;若钢铁表面的水膜呈酸性,则此时钢铁发生____________腐蚀,正极的电极反应式为____________________,负极的电极反应式为_____________________,电池总反应式为______________。
21.(2分)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为_________________________。
18. 液氨与水性质相似,也存在微弱的电离:2NH3
液氨与水性质相似,也存在微弱的电离:2NH3  NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是( )
A.液氨的电离度
B.液氨的离子积常数
C.c(NH4+)
D.c(NH2-)
19. 将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g)
NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是( )
A.液氨的电离度
B.液氨的离子积常数
C.c(NH4+)
D.c(NH2-)
19. 将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g) 2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 C.2 s时物质A的转化率为70% D.2 s时物质B的浓度为0.7 mol/L 20. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是:( )
A.
反应的化学方程式为:2M N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
17. 用石墨作电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+ 的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
16.根据热化学方程式:S(s)+O2(g) == SO2(g);△H =-297.23 kJ. mol-1,分析下列说法正确的是( )
A.S(g)+O2(g) == SO2(g) ;△H=Q,Q值大于297.23 kJ. mol-1
B.S(g)+O2(g) == SO2(g) ;△H=Q,Q值小于297.23 kJ. mol-1
C. SO2(g == S(g)+O2(g) ;△H=Q,Q值为负值,其绝对值小于297.23 kJ. mol-1
D. SO2(g) == S(g+O2(g) ;△H=Q,Q值为正值,其绝对值大于297.23 kJ. mol-1
13. 为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是( ) A.稀释 B.加稀硫酸 C.加NaOH溶液 D.加热 14.下列离子方程式书写正确的是( )
A、次氯酸钙溶液中通入过量的二氧化碳
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B、硫酸亚铁溶液中加入过氧化氢溶液
Fe2++2H2O2+4H+=Fe3++4H2O
C、用氨水与少量的二氧化硫反应
NH3·H2O+SO2=NH4++HSO3‑
D、硝酸铁溶液中加过量氨水
 Fe3++3 NH3·H2O=Fe(OH)3↓+3NH4+
15. 已知某可逆反应:mA(g)+nB(g)
Fe3++3 NH3·H2O=Fe(OH)3↓+3NH4+
15. 已知某可逆反应:mA(g)+nB(g)  pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是(
)
pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是(
)
A、T1<T2,P1>P2,m+n>p,△H>0
B、T1>T2,P1<P2,m+n<p,△H>0
C、T1>T2,P1<P2,m+n<p,△H<0
D、T1>T2,P1>P2,m+n>p,△H<0
12.下列叙述正确的是:( )
A.铜锌原电池中铜是正极
B.用电解法精炼铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时可用铜作阳极
11、
当CH3COOH  CH3COO-+H+已达平衡,若要使醋酸的电离度和溶液的pH值都减小,应加入的试剂是( )
A.CH3COONa
B.NH3·H2O C.
HCl
D.H2O
CH3COO-+H+已达平衡,若要使醋酸的电离度和溶液的pH值都减小,应加入的试剂是( )
A.CH3COONa
B.NH3·H2O C.
HCl
D.H2O
10. 在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )
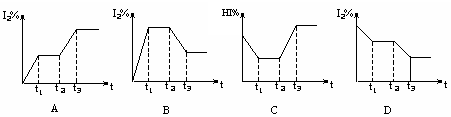
9.  反应3H2(g) + N2(g) 2NH3(g) ; ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
反应3H2(g) + N2(g) 2NH3(g) ; ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
A.随温度升高K增加 B 随压强升高K增加
C.随温度升高K减小 D随压强升高K减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com