
27. (各1分)(1)①末搅拌 ②末冷却即转移 ③末用玻璃棒引流 ④末用胶头滴管加水定容 ⑤末振荡、摇匀 (2)酸式 “0”刻度或“0” 以下刻度 (3)碱式滴定管,锥形瓶 甲基橙 黄色 橙色 (4)80% (5)A、B、C、D、E
24.(各1分)CO32-水解,c(CO32-)减小;CO2与Na2CO3发生反应生成NaHCO3 0.12mol/L 25. (各1分) (1)900 (2)1000 (3)81.8 (4)42.85 四、26. (各1分) (1)BD (2) 红,中;小于
23.(各1分)固或液;固或液,气;n >3;放
22.吸氧(1分),O2 +2H2O+4e- == 4OH-(1分),Fe -- 2e-==Fe2+(1分),2Fe + 2H2O +O2 == 2Fe(OH)2(1分);析氢(1分),2H+ +2e-=H2↑(1分), Fe - 2e- ==Fe2+(1分),2H+ +Fe== H2↑+ Fe2+(1分)
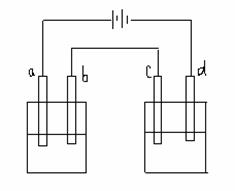
29.(4分)如图所示的电解装置中,A池盛有200ml饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
(1)A、B两池中阳极上各产生什么气体?写出电极反应式,并计算标准状况下气体各为多少升?
(2)电解后,A、B两池中pH值各为多少?(设溶液体积不变,也不考虑溶液的水解)
综合测试题一
28.(6分)将0.05mol/l的盐酸和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得溶液pH值为12,用上述氢氧化钠溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时,消耗氢氧化钠溶液12.5ml,试求:
(1) 氢氧化钠溶液的物质的量浓度?
(2) 此一元弱酸的物质的量浓度?
26. (4分)中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25℃时,若溶液的pH=7,试纸不变色;若pH〉7, 试纸变蓝色。而要精确测定溶液的pH,需要用pH计。pH计主要通过测定溶液的c(H+),来测定溶液的pH。
(1)已知水中存在如下平衡:H2O+ H2O
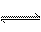 H3O++OH-; △H>0kJ·mol-1
现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)
A.向水中加入NaHSO4
B. 向水中加入Cu(NO3)2
C. 加热水至100℃[其中c(H+)=1×10-6mol·L-1]
D. 向水中加入(NH4)2SO4
(2)现要测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显_______色,溶液呈_____性(填酸、碱或中);若用pH计测定,则pH________7(填“大于”、“等于”或“小于”)
27.(14分 )实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
H3O++OH-; △H>0kJ·mol-1
现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)
A.向水中加入NaHSO4
B. 向水中加入Cu(NO3)2
C. 加热水至100℃[其中c(H+)=1×10-6mol·L-1]
D. 向水中加入(NH4)2SO4
(2)现要测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显_______色,溶液呈_____性(填酸、碱或中);若用pH计测定,则pH________7(填“大于”、“等于”或“小于”)
27.(14分 )实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1) 托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
①____________________②__________________③____________________________
④____________________⑤___________________。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器 有。用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,末洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读滴定管开始时仰视,读终点时俯视
25. (4分)常温下有一pH为12的NaOH的溶液100mL,如果将其PH降为11,那么 (1)若用蒸馏水应加入 mL (2)若用pH=10的NaOH溶液应加入 mL (3)若用pH=2的盐酸应加入 mL; (4)若用0.01m01·L-1H2SO4应加入 mL。
24.(3分)某温度下0.1mol/LNa2CO3溶液中c(Na+)/c(CO32-)=20/9,其原因是_________________________。现往Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(CO32-)=5/2,其原因是________________________,此时c(HCO3-)的物质的量浓度为_________________________(体积变化忽略)。
23.(5分)对于A + 2B(g) n C(g) ;△H在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为________态。
(2)增压,平衡不移动,当n=2时,A的状态为_______;当n=3时,A的状态为_______。
(3)若A为固态,增大压强,C的百分含量减少,则n=________。
(4)升温,平衡向右移动,则该反应的逆反应为____热反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com