
1、碳元素组成的不同单质金刚石、石墨和C60的物理性质及主要用途。
16、某同学在科技活动课上用如图所示的实验装置论证质量守恒定律,瓶内放了足量的盐酸,a是未充气的气球,里面放了6.5g锌粉,将它紧紧套在瓶口上(如图1),将图1的装置在托盘天平上称量质量W1g,然后将气体球内锌粉全部倒入瓶内,立即产生气体,气球逐渐胀大,锌全部反应(如图2),反应结束后,再次称量,质量为W2g,结果W1>W2,于是该同学认为此反应不遵守质量守恒定律,请你分析:(1)该同学的结论对吗?为什么?(2)根据人类对质量守恒定律的研究你认为在验证这一定律时要注意哪些问题?
答:(1)不对。该反应遵守质量守恒定律,因为在此实验条件下,W2<W1,是由于图2中产生大量的H2气球膨胀,在空气中产生浮力的缘故。(2)我认为应注意以下问题:①该反应是否为化学反应;②反应前后各种物质的质量不能漏掉;③根据反应物、生成物的状态及条件设计实验;④正确操作。
第六讲 碳和碳的氧化物
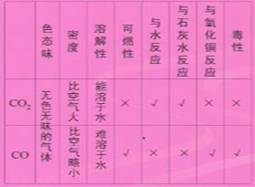

15、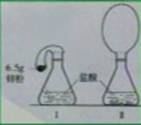 二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑灭,因为镁能在二氧化碳中燃烧,生成黑色和白色两种固体粉末,写出该化学方程式。
二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑灭,因为镁能在二氧化碳中燃烧,生成黑色和白色两种固体粉末,写出该化学方程式。
2Mg+CO2点燃2MgO+C
14、哥伦比亚号宇宙飞船曾用金属铝粉和高氯酸铵(NH4ClO4)作固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热生成四种气体:两种气体是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液体)。试写出其中涉及到的反应的化学方程式。
4Al+3O2加热2Al2O3
2NH4ClO4加热N2↑+2O2↑+Cl2↑+4H2O↑
13、在反应aXaYb+8Z=cX+bZ2Y3中,a= 3 ,b= 4 ,c= 9 。(列方程组)
12、某化合物在纯氧中燃烧生成CO2和SO2,两者的质量之比为11:32,该化合物中一定含有 碳 和 硫 两种元素,若此化合物的1个分子中含有3个原子,则此化合物的化学式为 CS2 ,此化合物在纯氧中燃烧的化学方程式为:CS2+3O2点燃CO2+2SO2 (质量比除以相对质量比,得到分子个数比。)
11、通电分解水时得到10g氢气的同时可以得到 10 g氧气,等到10ml氢气的同时可以得到 5 ml氧气。(同温同压下,气体的体积与分子个数成正比。)
10、实验室用10g高锰酸钾放在试管里加热,一段时间后,称得剩余固体的质量是9.2g,则剩余物质是(D)(“一段时间后”不等于“完全加热后”,说明反应物可能有剩余。根据化学方程式,反应物由10g,剩余9.2g,少掉的应是氧气0.8g,生成0.8g氧气只需要7.9g高锰酸钾,从理论上证明了反应物有剩余。)
A、K2MnO4和MnO2 B、K2MnO4 C、KMnO4和K2MnO4 D、KMnO4和K2MnO4和MnO2
9、某同学用一氧化碳将8g氧化铜还原成铜时,实际消耗一氧化碳的质量可能是(BC)(理论上要消耗2.8克一氧化碳,实际上要超过。本实验过程中,因一氧化碳可燃,加热前要先通入一氧化碳一会儿,加热后还要再通入一氧化碳一会儿。氢气还原氧化铜的实验,也要看清是“理论上”还是“实际上”。)
A、2.8g B、4g C、3.5g D、2.6g
8、在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如右表,下列推理正确的是(AD)(X由4g到0g,说明X一定是反应物,Y、Z的质量有所增加,说明Y、Z是生成物,且生成物的质量分别是2g、14g,总共才有了4g的反应物X,那么Q不可能再是生成物了,只能是反应物,根据质量守恒定律,Q应是12g。)
A、反应物是X和Q,生成物是Y和Z B、反应后生成15gZ
C、参加反应的Y和Q的质量比是1:1 D、参加反应的X与Q的质量比是1:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com