
4、物质溶解时,往往会引起温度的改变。溶解的过程发生两个变化,一种是溶质的分子或离子向水中扩散的过程,要吸收热量;另一种是溶质的分子或离子与水分子作用形成水合分子或离子过程,要放出热量。当吸热小于放热时,溶液温度降低,反之升高。
3、溶液和浊液的比较。不同点:溶液是均一的、稳定的;浊液是不均一、不稳定的,久置后会出现下沉或分层。相同点:都是混合物。
2、溶液具有均一性和稳定性的特征。均一性指溶液各部分密度、浓度、性质都相同。稳定性指外界条件不改变,溶液久置不出现沉淀,不分层。
1、溶液、溶质、溶剂的概念
18、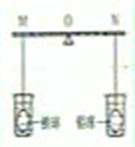 在杠杆两端分别挂着质量和表面积都相同的铁球和铝球,这时杠杆平衡。将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止。两球的外形变化不大,且无孔洞出现,试回答:
在杠杆两端分别挂着质量和表面积都相同的铁球和铝球,这时杠杆平衡。将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止。两球的外形变化不大,且无孔洞出现,试回答:
(1)铁球和铝球分别与稀硫酸反应的化学方程式依次是:
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)+3 H2↑
(2)下列有关铁球和铝球内部情况的叙述正确的是(AD)
A、铁球一定是空心的 B、铁球可能是空心的
C、铜球一定是空心的 D、铜球可能是空心的
(3)烧杯中不再产生气泡时,拿掉烧杯,出现的情况应是(B)
A、杠杆仍然保持平衡 B、要想使杠杆保持平衡,支点应向右移动
C、要想使杠杆保持平衡,支点应向左移动
第九讲 溶液
17、某同学在厨房中进行了观察和思考,请推测他的总分思考内容:
(1)蜂窝煤在炉中燃烧时,闻到一股刺激性气味,他推测该刺激性气体是 SO2 。(煤碳中的S与空气中氧气反应后的产物。)
(2)厨房中空气较为潮湿,一些金属制品锈蚀较快,他认为这与上述刺激性气体在潮湿空气中变成硫酸酸雾有关联,其反应的化学方程式是 2SO2+2H2O+O2=2H2SO4 。这种酸的溶液腐蚀钢铁制品的反应方程式为 Fe+H2SO4=FeSO4+H2↑ 。
16、设计简单实验区分铜粉和铁粉,写出方法、现象和结论。
答:方法一:(方法)取样,分别用磁铁吸引,(现象)能被吸引的(结论)是铁粉,(现象)不能被吸引的(结论)是铜粉。方法二:取样,分别加入稀盐酸,表面有气泡生成的是铁粉,无气泡生成的是铜粉。(方法一依据其物理性质,方法二依据其化学性质,都写全了方法、现象、结论。)
15、与金属跟化合物溶液的转换反应规律相似,非金属也有类似规律,已知实验事实为:Br2+2NaI=2NaBr+I2。Cl2+2NaBr=Br2+2NaCl。则三种非金属元素的活动性由强到弱的顺序是 Cl>Br>I 。
14、在硫酸锌溶液中混有少量CuSO4溶液,可加入 足量锌粒 充分反应后 过滤 ,即能除去杂质,反应的方程式为 Zn+CuSO4=Cu+ZnSO4 。
13、自行车用久了表面会出现 红 色的铁锈,其主要成份是 Fe2O3 ,这是由于铁跟 水、氧气 发生缓慢氧化而生成的,自行车的下列部件采用的防锈方法分别是链条 涂油 ,
支架 刷漆 ,钢圈 电镀 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com