
12、实验室用密度为1.84g/cm3的浓硫酸,配制500g质量分数为20%的稀硫酸。欲计算所需浓硫酸的体积,你认为下列说法正确的是(C)
A、还需要已知水的密度为1g/ cm3
B、还需已知20%的稀硫酸的密度为1.14g/ cm3
C、还需已知密度为1.84 g/ cm3的浓硫酸的溶质质量分数为98%
 D、题中条件充分,不需补充其他数据
D、题中条件充分,不需补充其他数据
11、现有溶质质量分数为20%的盐酸100g,当蒸发掉2g溶剂水后,剩下的盐酸溶液的溶质质量分数是(C)(错误解法:盐酸溶液中溶质质量分数=(100g×20%)÷(100g-2g)×100%>20%。分析:盐酸具有挥发性,加热时溶质质量减小。)
A、大于20% B、等于20% C、小于20% D、无法确定
10、下列生活用品中,通常用加热方法配制浓溶液的是(A)(蔗糖的溶解度随温度升高而增大。氢氧化钙的溶解度随温度的升高而降低。食盐的溶解度随温度变化不大。气体的溶解度随温度升高而减少。)
A、用于调味的糖水 B、粉墙用的石灰浆 C、腌制蛋类的食盐水 D、夏天自制汽水
9、下列说法正确的是(A)(B中未说明是否饱和状态。溶解度概念中的溶剂质量应是100克。溶解度应有单位,克。)
A、在一定温度时,某物质在饱和溶液和不饱和溶液中的溶解度是相同的
B、20℃时,50g水中溶解了10gNaCl的溶解度为20g
C、溶解度曲线上的任意一点,表示一定温度和一定量的溶剂里溶解溶质的质量
D、20℃时,磷酸钾的溶解度为31.6
8、在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:溶液甲,蒸发5g水后无晶体析出,得到溶液乙;溶液乙,蒸发5g水析出2g晶体,得到溶液丙。下列结论正确的是(CD)(溶液甲蒸发无晶体析出,所以肯定是不饱和溶液;溶液乙蒸发水时有晶体析出,所以溶液丙肯定是饱和溶液。溶液乙有两种可能,可能是饱和溶液,可能是不饱和溶液。)
A、溶液甲一定是饱和溶液
B、溶液乙一定是不饱和溶液
C、溶液乙和溶液丙中的溶质质量分数可能相等
D、溶液丙若再蒸发5g水析出的晶体可能大于2g
7、向Ca(OH)2饱和溶液中少量CaO,若温度保持不变,下列叙述正确的是(CD)(CaO+H2O=Ca(OH)2,所以Ca(OH)2饱和溶液中溶剂质量质量减少,有晶体析出,所以饱和溶液中溶质的质量减少。析出晶体后的溶液是同温度下的饱和溶液,所以溶质质量分数不变。)
A、溶质质量不变 B、溶液中溶质质量增多
C、溶液中溶剂质量减少 D、溶液中溶质质量分数不变
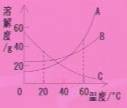
6、右图是甲、乙、丙三种物质的溶解度曲线。当它们接近饱和时,能分别通过加溶质、蒸发溶剂、升温等方法变成饱和溶液的是(C)
A、甲溶液 B、乙溶液 C、丙溶液 D、甲、乙的混合溶液
5、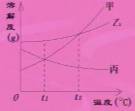 t℃时,有两瓶碳酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10%的溶液,下列实验操作中,无法区分这两种溶液的是(A)(B、C、D选项中三种操作都能使饱和碳酸钾溶液析出晶体,而10%的碳酸钾溶液中无明显现象;A选项中两溶液均无明显现象。)
t℃时,有两瓶碳酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10%的溶液,下列实验操作中,无法区分这两种溶液的是(A)(B、C、D选项中三种操作都能使饱和碳酸钾溶液析出晶体,而10%的碳酸钾溶液中无明显现象;A选项中两溶液均无明显现象。)
A、加入一定量的水 B、加少量碳酸钾晶体 C、略降低温度 D、t℃时蒸发少量水
4、下列关于固态物质的饱和溶液的说法中,正确的是(D)(饱和溶液的概念要强调一定温度下和一定量的溶剂。硝酸钾饱和溶液不能继续溶解硝酸钾,但可继续溶解蔗糖。B要强调同一温度下。熟石灰的饱和溶液就是稀溶液。)
A、饱和溶液就是不能继续溶解溶质的溶液
B、同一溶液的饱和溶液一定比其不饱和溶液浓
C、饱和溶液一定是浓溶液
D、饱和溶液在一定条件下可转化为不饱和溶液
3、向右图试管里的水中加入下述某种物质后,原来U型管内在同一水平上的红墨水,右边液面降低了些,左边液面上升了些,则加入的物质是(C)(分析:U型管中,红墨水左边高,右边低的状况,说明广口瓶内气体压强变得比大气压小,原因是在试管中水里,加入某种物质因溶解,使温度降低而引起气压减小。活性炭难溶于水,生石灰和烧碱溶于水后溶液温度升高,硝酸铵溶于水后溶液温度降低。)
A、活性炭 B、生石灰 C、硝酸铵 D、烧碱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com