
4.硫酸
①稀H2SO4具有酸的一般通性,而浓H2SO4具有酸的通性外还具有三大特性:
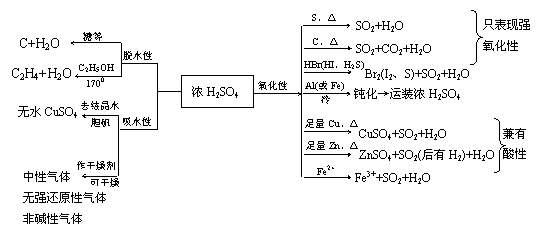
② 的鉴定(干扰离子可能有:
的鉴定(干扰离子可能有: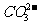 、
、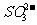 -、
-、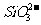 -、Ag+、
-、Ag+、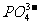 等):
等):
待测液 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子)
③硫酸的用途:制过磷酸钙、硫酸铵、硫酸铜、硫酸亚铁、医药、炸药,用于铅蓄电池,作干燥剂、制挥发性酸、作脱水剂和催化剂等
3.硫的氧化物
(1)二氧化硫:
①SO2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③SO2有强还原性 常见氧化剂(见上)均可与SO2发生氧化一还原反应
如:SO2 + Cl 2 +2H2O == H2SO4 + 2HCl
④SO2也有一定的氧化性 2H2S + SO2 == 3S↓ +2H2O
⑤SO2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)
⑥实验室制法:Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑
或Cu +
2H2SO4(浓) 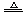 CuSO4
+ 2H2O + SO2↑
CuSO4
+ 2H2O + SO2↑
(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热
(3)比较SO2与CO2、SO3
|
|
SO2 |
CO2 |
SO3 |
|
主要物性 |
无色、有刺激性气体、易液化易溶于水(1:40) |
无色、无气味气体能溶于水(1:1) |
无色固体.熔点(16.8℃) |
|
与水反应 |
 SO2+H2O H2SO3 中强酸 SO2+H2O H2SO3 中强酸 |
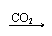 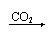  CO2+H2O H2CO3
弱酸 CO2+H2O H2CO3
弱酸 |
SO3+H2O==H2SO4(强酸) |
|
与碱反应 |
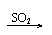 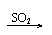  Ca(OH)2
CaSO3↓ Ca(HSO3)2 Ca(OH)2
CaSO3↓ Ca(HSO3)2清液 白 清液 |
Ca(OH)2 CaCO3↓ Ca(HCO3)2 清液 白↓ 清液 |
SO3+Ca(OH)2==CaSO4(微溶) |
|
紫色石蕊 |
变红 |
变红 |
变红 |
|
品红 |
褪色 |
不褪色 |
不褪色 |
|
鉴定存在 |
能使品红褪色 又能使清石灰变浑浊 |
不能使品红褪色 但能使清石灰水变浑浊 |
|
|
氧化性 |
SO2+2H2S=2S↓+2H2O |
CO2+2Mg = 2MgO+C CO2+C = 2CO |
|
|
还原性 |
有 |
无 |
|
|
与Na2O2作用 |
Na2O2+SO2==Na2SO4 |
2Na2O2+2CO2==2Na2CO3+O2 |
2Na2O2+2SO3 ==2NaSO4+O2↑ |
2.硫的氢化物
H2S是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大
硫化氢的化学性质
A.可燃性:当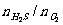 ≥2/1时,2H2S+O2
≥2/1时,2H2S+O2 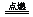 2S+2H2O(H2S过量)
2S+2H2O(H2S过量)
当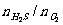 ≤2/3时,2H2S+3O2
≤2/3时,2H2S+3O2 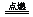 2SO2+2H2O(O2过量)
2SO2+2H2O(O2过量)
当 时,两种反应物全部反应完,而产物既有硫又有SO2
时,两种反应物全部反应完,而产物既有硫又有SO2
B.强还原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S氧化。
C.不稳定性:300℃以上易受热分解
③H2S的水溶液叫氢硫酸,是二元弱酸
1.硫
(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)
2Na+S===Na2S (剧烈反应并发生爆炸)
2Cu + S 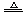 Cu2S(黑色)
Cu2S(黑色)
②与非金属反应
S+O2
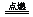 SO2
SO2
S+H2 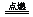 H2S(说明硫化氢不稳定)
H2S(说明硫化氢不稳定)
③与化合物的反应
S+6HNO3(浓)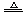 H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
 S+2H2SO4(浓)
S+2H2SO4(浓)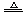 2SO2↑+2H2O
2SO2↑+2H2O
3S+6NaOH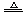 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
1、氧族元素的原子结构及性质的递变规律
|
元素 |
氧(O) |
硫(S) |
硒(Se) |
碲(Te) |
|
核电荷数 |
8 |
16 |
34 |
52 |
|
最外层电子数 |
6 |
6 |
6 |
6 |
|
电子层数 |
2 |
3 |
4 |
5 |
|
化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
-2,+4,+6 |
|
原子半径 |
|
|||
|
密度 |
|
|||
|
与H2化合难易 |
点燃剧烈反应 |
加热时化合 |
较高温度时化合 |
不直接化合 |
|
氢化物稳定性 |
|
|||
|
氧化物化学式 |
-- |
SO2 SO3 |
SeO2 SeO3 |
TeO2 TeO3 |
|
氧化物对应水化物化学式 |
-- |
H2SO3 H2SO4 |
H2SeO3 H2SeO4 |
H2TeO3 H2TeO4 |
|
最高价氧化物水化物酸性 |
|
|||
|
元素非金属性 |
|
5、它由“风”编织而成,它汲汨罗江水养育成长。它曾摇响在南山东篱下,它曾摇响在天姥山脚、岱宗绝顶、浔阳江头,它也曾摇响在古道、栈桥、杨柳岸,溪亭、孤舟、桃花林。
4、我们的成长要摆脱低俗事物的纷扰,用传统文化来滋养。有句话叫柔日读史,刚日读经。是说意志懈怠时读史以明志:谋臣策士,家国三寸簧舌里;金戈铁马,江山万里血泪中。读史书,能养浩然正气。也是指骄躁狂暴时读经以养性:老庄之道,清净无为是非空;菩提之心,灵台空明尘埃无。读经书,能塑静俭德性。我国浩瀚的书海之中,蕴含着无尽的宝藏,它们是我们成长真正的养分。
3、朝阳与落日总是更能令人感动,只因那一刻他正午的锋芒熔成了圆润的辉光。
2、似乎,生命如征程,人的一生注定疾步匆匆,从古到今……
1、人生弯弯曲曲水,世事重重叠叠山。热情去奔跑,去超越,然后才能拾掇失意后的坦然,挫折后的不屈,困苦艰难后的从容。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com