
9. (09上海卷26)根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
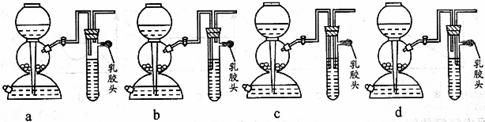
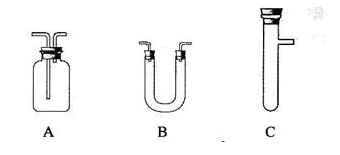
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
______________(填编号)。
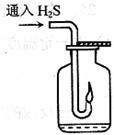

(3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
的现象是___________________________________________________。
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
______________________________________________________________
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
答案:
(1)a d
(2)② ③ ④
(3)品红溶液褪色:瓶壁有淡黄色粉末和无色的小液滴
(4) 变大
变大
(5)b
(6)S H2O

8. (09四川卷26)(16分)
(09四川卷26)(16分)
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量
请填写下列空白:
(1)
移取10.00
m密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
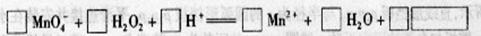
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________
______________________________________________________________。
(4) 复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾演粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
答案:
I.(1)容量瓶
(2)2 5 6 2 8 502
(3)酸式
滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
 (4)
(4)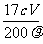
(5)偏高
II.(各1分,共4分)
|
实验内容 |
实验方法 |
实验现象 |
|
验证氧化性 |
取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液。 (取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液。) |
产生淡黄色沉淀或溶液变浑浊。 (溶液变蓝色。) |
|
验证不稳定性 |
取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验。 (取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中。) |
产生气泡,木条复燃。 (溶液变浑浊或有浅黄色沉淀产生) |
7. (09全国卷Ⅰ27)(15分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
2 H2SO4 (浓) + C  CO2↑+ 2 H2O
+ 2SO2↑
CO2↑+ 2 H2O
+ 2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
 将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
|
|
|
答案:
C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 澄清石灰水 检验CO2的存在。
解析: 成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,最后再用装置A,放入澄清石灰水来检验CO2的存在,因SO2也可以使澄清石灰水变浑,故先要除去SO2。
成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,最后再用装置A,放入澄清石灰水来检验CO2的存在,因SO2也可以使澄清石灰水变浑,故先要除去SO2。
6. (09北京卷8)下列叙述正确的是
A.将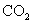 通入
通入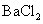 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入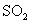 ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入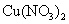 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向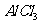 溶液中滴加氨水,产生白色沉淀;再加入
溶液中滴加氨水,产生白色沉淀;再加入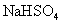 溶液,沉淀消失
溶液,沉淀消失
 D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量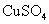 固体,速率不改变
固体,速率不改变
答案:C
5.(08上海卷)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+N2O5 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4
C.浓H2SO4滴入萤石中,加热
D.加入少量的H2SO4使乙酸乙酯水解
答案:B、D
解析:在反应①中NO2起氧化剂的作用,从反应①、③看NO2起催化作用,选项A中浓硫酸起吸水剂的作用;选项B中浓硫酸起氧化剂作用;选项C中浓硫酸起酸性作用;选项D中浓硫酸起催化剂作用
4. (09广东化学17) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应: 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
答案:CD
解析:结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;
2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,
H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
3. (09福建卷7)能实现下列物质间直接转化的元素是 ( )
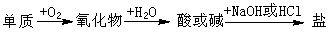
A. 硅 B. 硫 C. 铜 D. 铁
答案 B
解析 S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错
1. (2007年高考全国理综卷I)下列有关环境问题的说法正确的是 ( )
A. 燃煤时加入适量石灰石,可减少废气中SO2的量
B. 臭氧的体积分数超过10-4%的空气有利于人体健康
C. pH在5.6-7.0之间的降水通常称为酸雨
D. 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
答案 :A
2 (08年广东理基·22)保护环境已经成为人类的共识。人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用。下列做法不利于环境保护的是
A.发电场的煤见脱硫处理
B.将煤转化为水煤气作燃料
C.回收并合理处理聚乙烯塑料废物
D.电镀废液经中和后直接排放
 答案:D
答案:D
2.尾气处理: 氨水 (NH4)2SO3 (NH4)2SO4+ SO2↑
NH4HSO3
四、环境和环境保护
环境污染及类型:
按环境要素分:①大气污染
②水体污染
③土壤污染
按造成污染的性质来分:
①化学污染
②生物污染
③物理污染
④固体废弃物污染
⑤能源污染

击破考点一:同主族元素性质递变规律及其应用
例1:判断氧的非金属性比硫强的事实是( )
A.氢硫酸敞口放置于空气中变浑浊
B.常温下Hg不与O2反应而与硫粉反应
 C. Fe在氧气中燃烧生成Fe3O4,而与硫反应生成FeS
C. Fe在氧气中燃烧生成Fe3O4,而与硫反应生成FeS
D.氧的游离态大量存在于空气中;而硫的游离态主要存在于火山口喷口处
答案:A、C
解析: 根据元素非金属性强弱的具体表现:氢化物的稳定性、还原性及生成的难易;最高价氧化物对应水化物酸性的强弱;非金属单质间的置换反应;使同种还原剂中元素化合价升高的多少等
点评:根据元素周期律掌握氧族元素及其化合物性质递变规。
[变式训练1]下列关于硫的叙述中,正确的是[ ]
A. 硫的非金属性较强,故只能以化合态存在于自然界中
B. 能与Cu、Fe、O2等物质反应,S作氧化剂
C. 硫燃烧得SO3 ,可以制得硫酸
D. S与Cu反应生成Cu2S ,而不能生成CuS
答案:D
解析:硫在自然界中既可以以游离态存在,也能以化合态存在。S与Cu、Fe、O2等物质反应S作还原剂 。硫燃烧得SO2
[变式训练2]下列关于硒的叙述中,不正确的是( )
A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se
B.硒化氢有恶臭味,有毒,比硫化氢易分解
C.硒化氢在空气中不能燃烧
D.亚硒酸(H2SeO3)是一种弱酸
答案:C
解析:硒和硫同属氧族元素,但硒的核电荷数,原子半径都比硫大,这两种元素除化学性质相似外,硒的非金属性比硫弱,据此可作 硫在空气中燃烧生成二氧化硫;与钠能组成化合物Na2S;硫化氢有臭鸡蛋气味,有剧毒;硫化氢在空气充足时燃烧生成二氧化硫和水,在空气不足时燃烧生成硫单质和水;亚硫酸为中强酸 而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
击破考点二:二氧化硫的性质
例2:对某酸性溶液(可能含有Br-,SO42- ,H2SO3,NH 4+ )分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是 ( )
 A.
A.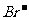 B.
B. C.
C.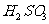 D.
D. 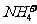
答案:B
解析:加热使品红褪色说明有二氧化硫,由题目可知一定有H2SO3。加热时放出的气体可以使湿润的红色石蕊试纸变蓝可知一定有NH 4+加入氯水时,溶液略显黄色推知有Br-存在。产生的白色沉淀不溶于稀硝酸,此白色沉淀应该为硫酸钡,但有可能是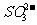 被氧化得到硫酸根。所以不能确定是否有硫酸根离子。
被氧化得到硫酸根。所以不能确定是否有硫酸根离子。
点评:高考重点考察二氧化硫的氧化性、还原性、漂白性
漂白性:SO2使品红溶液褪色
漂白原理的比较
具有漂白作用的物质,按其漂白原理可分为三类:
(1)氧化型:此类物质有:HClO、Ca(ClO)2、Na2O2、浓HNO3、H2O2、O3等强氧化性物质
(2)加合型:这种漂白是可逆的、不彻底的。如SO2使品红溶液褪色,加热又恢复原有颜色(SO2不漂白酸碱指示剂)。
(3)吸附型:如活性炭
注意:SO2与CO2的相互鉴别
鉴别SO2气体的常用方法是用品红溶液,看能否使其褪色,有时还需再加热看能否再复原。
鉴别CO2气体的常用方法是用澄清石灰水,看能否使其变浑浊,足量时再变澄清。
当混有CO2时,不会影响SO2的鉴别;
当混有SO2时会干扰CO2的鉴别,应先除去SO2后再用澄清石灰水鉴别CO2气体
除去CO2中的SO2,常用方法是使混合气体先通过足量溴水或酸性KMnO4溶液或饱和NaHCO3溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽) 
[变式训练3]下列说法错误的是 ( )
A.Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀硝酸后沉淀消失
B.将SO2气体通入Ba(OH)2溶液中有白色沉淀生成
C.将SO2气体通入BaCl2溶液中有白色沉淀生成
D.将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成
答案:A 、C
解析:A加稀硝酸后亚硫酸钡被氧化为硫酸钡,沉淀不溶解,C根据强酸制弱酸的原理判断没有沉淀生成
[变式训练4]向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是 ( )
A.BaSO4 B.FeS C.BaSO3 D.S
答案:A
解析:此题隐含了Fe3+的强氧化性,容易误选C
 [变式训练5]向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
( )
[变式训练5]向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
( )
A.BaSO4 B.FeS C.BaSO3 D.S
答案:A
解析:此题考查SO2 的还原性
击破考点三:环境保护问题
例3:导致下列现象的主要原因,与排放SO2有关的是
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
答案:A
解析:酸雨的形成,主要与SO2的排放有关;光化学烟雾的形成,主要与烃类及氮氧化物有关;温室效应主要与烃类和CO2等有关
点评:二氧化硫的污染.
[变式训练6](08上海)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+N2O5 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4
C.浓H2SO4滴入萤石中,加热
D.加入少量的H2SO4使乙酸乙酯水解
答案:B、D
解析:在反应①中NO2起氧化剂的作用,从反应①、③看NO2起催化作用,选项A中浓硫酸起吸水剂的作用;选项B中浓硫酸起氧化剂作用;选项C中浓硫酸起酸性作用;选项D中浓硫酸起催化剂作用
[变式训练7]下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6-7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
答案:A
[变式训练8]下列有关环境保护的说法中错误的是
A.使用含磷洗衣粉会使水体富营养化
 B.减少二氧化硫的排放,可防止全球气候变暖
B.减少二氧化硫的排放,可防止全球气候变暖
C.含甲醛、苯及其同系物的装修材料对人体有害
D.随意丢弃废旧电池会造成重金属盐对土壤和水源的污染
答案:B
击破考点四:浓硫酸的特性
例4:有一定质量的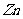 与
与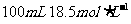 的浓
的浓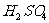 充分反应,
充分反应,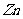 完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中
完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中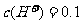
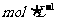 。则气体A中各组分的体积比为
。则气体A中各组分的体积比为 
答案: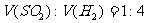
解析:反应后溶液为1L,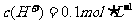 ,则
,则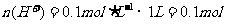 ,故反应后溶液中剩余硫酸0.05mol。由于浓硫酸与
,故反应后溶液中剩余硫酸0.05mol。由于浓硫酸与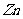 反应过程中浓度变稀,故有
反应过程中浓度变稀,故有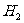 、
、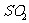 两种气体产生。设
两种气体产生。设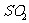 、
、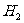 的物质的量分别为
的物质的量分别为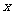 、
、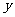

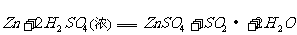
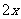
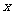
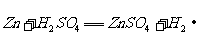
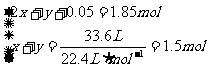
解得: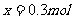
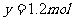
所以A气体中
点评:本题所考知识点为浓硫酸的氧化性,稀硫酸的酸性,氧化还原反应,气体摩尔体积
浓硫酸的三大特性中,最重要的是其强氧化性 关于吸水性和脱水性要求记住它们的区别:“有水吸水,无水脱水”。
关于吸水性和脱水性要求记住它们的区别:“有水吸水,无水脱水”。
[变式训练9](鞍山市13中学2009届高三第三次模拟考试)一定质量的Cu-Zn合金溶于足量的热浓硫酸中(忽略副反应),溶液所增加的质量与原合金质量之比为1∶A,则原合金中Zn、Cu的质量之比为( )
A. 65∶(A-65) B. 64∶(A-65)
C. 65∶(A-64) D. 64∶(A-64)
答案:A
[变式训练10] 写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系 。

(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → →
。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。
(5)装置③中所盛溶液是 ,可验证的产物是 
答案:

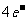
(1)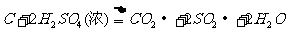
(2)④ ② ① ③
(3)验证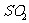 的存在 充分吸收
的存在 充分吸收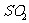 验证
验证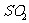 是否已被吸收完全
是否已被吸收完全
(4)无水硫酸铜 水 由于产物通过①③时会带出水蒸气,所以②必须放在①、③之前
(5)澄清的石灰水 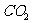
解析:上述反应中的生成物有三个:SO2、CO2、H2O,在检验这三种产物时要避免相互干扰,如检验CO2时一般用澄清石灰水,而SO2也会使澄清的石灰水变浑浊,所以在检验CO2之前必须先除去SO2;同时,在气体通过水溶液后,水蒸气会随之带出,所以必须在通过水溶液之前检验水的存在,由上分析装置的连接顺序是4→2→1→3
[变式训练11]下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
答案:D
击破考点五:硫酸根离子的检验
例5:检验某未知溶液中是否含有SO42-的下列操作中,最合理的是
A.加入盐酸酸化的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.加入盐酸酸化的氯化钡溶液 D.先加盐酸酸化,再加氯化钡溶液
 答案:D
答案:D
[变式训练12]在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是 ( )
A.一定含有
B.含有 和Ag+
和Ag+
C.可能 或Ag+或
或Ag+或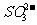 或同时含有
或同时含有 和
和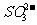
D.可能含有 或
或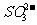
答案:C
击破考点六:硫酸工业中的相关计算
例6:以黄铁矿为原料生产硫酸的工艺流程图如下:
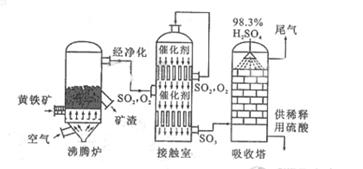
(1)将燃烧黄铁矿的化学方程式补充完整
4
+11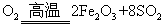
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)

a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高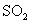 的转化率
的转化率
c. 使用催化剂能提高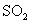 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g 气体与
气体与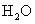 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的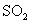 和铵盐。
和铵盐。
①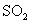 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的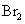 。
。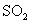 吸收
吸收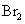 的离子方程式是
的离子方程式是

② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的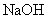 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量
部分测定结果;
 铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
答案 (1)FeS2
(2)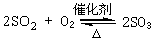
(3)a b d
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
(5)①
②14.56 2.31g
[变式训练13]工业用煅烧黄铁矿制硫酸:4FeS2 +11 O2 ===2Fe2O3 + 8SO2。用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫受到损失混入炉渣。SO2的转化率为97%。求1t黄铁矿可生产98%的硫酸多少砘?
答案:1.15 t
[变式训练14]某化工厂每小时生产a t 98%(质量分数)的硫酸。为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料的损失,则:
(1) 该厂每小时消耗标准状况下的空气体积为___________________m3
(2) 为满足题设要求,b%的下限为
答案:22400a/(21-b) ⑵ 7%

1.生产过程:
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
|
三方程 |
4FeS2(s)+11O2(g) = 2Fe2O3(s)+8SO2(g); △H=-3412 kJ/mol |
2SO2(g)+O2(g)  2SO3(g); 2SO3(g);△H=-196.6 kJ/mol |
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3
kJ/mol |
|
三设备 |
沸腾炉 |
接触室 |
吸收塔 |
|
有 关 原 理 |
矿石粉碎,以增大矿石与空气的接触面,加快反应速率 |
 逆流原理(热交换器)目的: 冷热气体流向相反,冷的SO2、O2、N2被预热,而热的SO3、SO2、O2、N2被冷却 逆流原理(热交换器)目的: 冷热气体流向相反,冷的SO2、O2、N2被预热,而热的SO3、SO2、O2、N2被冷却 |
逆流原理(98.3%的浓硫酸从塔顶淋下,气体由下往上,流向相反,充分接触,吸收更完全) |
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
SO2、O2、N2、SO3 |
尾气:SO2及N2、O2 不能直接排入大气中 |
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
反应条件-- 理论需要:低温、高压、催化剂;实际应用:400℃-500℃、常压、催化剂  |
实际用98.3%的浓硫酸吸收SO3,以免形成酸雾不利于气体三氧化硫被进一步吸收 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com