
19. 在密闭容器中发生反应:aX(气)+bY(气) cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
A.平衡向逆反应方向移动 B.a + b > c + d
C. Z的体积分数减小 D.X的转化率下降
18.一定条件下,在容积为2L的密闭容器里加入一定物质的量的A和B,发生如下反应并建立平衡:A(g)  2B(g) C(g)+2D(g) 测得平衡时各物质的浓度是:[A]=0.3 mol/L,[B]=0.2 mol/L,[C]=0.15 mol/L。最初向容器里加入A的物质的量是( )
2B(g) C(g)+2D(g) 测得平衡时各物质的浓度是:[A]=0.3 mol/L,[B]=0.2 mol/L,[C]=0.15 mol/L。最初向容器里加入A的物质的量是( )
A 0.5 mol B 0.8 mol C 0.9 mol D 1.2 mol
17. 在一恒容的密闭容器中,A(g)+B(g) C(g)的平衡体系中,若增大A的浓度而使平衡向右移动,当达到新的平衡时,则下列说法不正确的是( )
在一恒容的密闭容器中,A(g)+B(g) C(g)的平衡体系中,若增大A的浓度而使平衡向右移动,当达到新的平衡时,则下列说法不正确的是( )
A.A的平衡浓度一定比原来平衡时大 B.B的平衡浓度一定比原来平衡时小
C.C的百分含量一定比原来平衡时大 D.A的转化率一定比原来平衡时大
16.在0.lmol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是( )
A 加入少量NaOH固体,平衡向正反应方向移动
B 加水,反应速率加快,平衡向逆反应方向移动
C 滴加少量0.lmol/L HCl溶液,溶液中[H+]减少
D 加入少量CH3COONa固体,平衡向逆反应方向移动
15.能正确表示下列反应的离子方程式是( )
A、铜与浓硝酸反应:Cu+4H++2NO3-== Cu2++2NO2↑+2H2O
B、纯碱与水反应:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D、硫酸氢钠与氢氧化钠溶液反应:H++OH-= H2O
14.X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
13.一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是 ( )
2NH3(g)达到化学平衡状态的标志是 ( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.N2,H2和NH3的物质的量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2
12.在相同状况下的两杯甲酸溶液,第一杯甲酸溶液的浓度为c1,其电离度为α1;第二杯甲酸溶液的浓度为c2,其电离度为α2。若第二杯甲酸溶液中甲酸根离子的浓度恰为c1,则必然有( )
A 第一杯溶液的pH值大于第二杯溶液的pH值
B c1>c2
C α1<α2
D α1>α2
11. 反应2X(g)+Y(g) 2Z(g) ;△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
反应2X(g)+Y(g) 2Z(g) ;△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
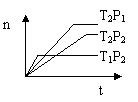 A T1<T2,P1<P2 B T1<T2,P1>P2
A T1<T2,P1<P2 B T1<T2,P1>P2
C T1>T2,P1>P2 D T1>T2,P1<P2
8. 下列说法不正确的是( )
A、0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] B、在大试管中加入5~10mL1mol/LHCl,再加入1mL水玻璃,然后用力振荡,可制得硅酸溶胶 C、向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:[NH4+] = [Cl-] D、pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 9. 用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+) ,下列关系式正确的是( )
A.c(H+)>c(OH-) B.c(HCN)<c(CN-) C.c(CN-)+c(OH-)=0.1mol·L-1 D.c(HCN)+c(CN-) =0.2mol·L-1 10. 在一支25 mL的酸式滴定管中盛入0.1 mol·L-1 HCI溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1 NaOH溶液进行中和,则所需NaOH溶液的体积 ( )
A. 大于20 mL B. 小于20 mL C. 等于20 mL D. 等于5mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com