
2.能证明醋酸是弱酸的事实是 ( )
A.能溶于水
B.能使紫色石蕊试液变红
C.能被弱碱氨水中和
D.常温下,0.1 mol·Lˉ1醋酸溶液中的c(H+)为1.32×10ˉ3 mol·Lˉ1
1.工业上常用氯气给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A.碳酸钠 B.硝酸银 C.亚硫酸钠 D.氯化铁
29.(1)已知氯化银在水中的溶解平衡为:
AgCl(s) 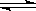 Ag+(aq) + Cl-(aq),其Ksp为:Ksp = · = 1.8 × 10-10 mol2·L-2
Ag+(aq) + Cl-(aq),其Ksp为:Ksp = · = 1.8 × 10-10 mol2·L-2
现把氯化银(足量)分别放人:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答) 。在0.1mol·L-l氯化铝溶液中,银离子的物质的量浓度最大可达到 mol·L(2)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp=1.8×10-11,KsP =2.2×10-20。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数K=__________
28、已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c (NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则⑴上述关系一定不正确的是 (填序号)
⑵若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系
为 (填序号)
⑶若关系③正确,则溶液中溶质为 。
⑷25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填“>”、“<”、“=”、“无法确定”)
⑸若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,)
27、(1)常温下,amL0.1mol/LCH3COOH与bmL0.1mol/LNaOH混合,充分反应。
①若a=b,则反应后溶液中离子浓度从大到小的顺序是
②若混合后溶液呈中性,则a b,反应后溶液中C(CH3COO-) C(Na+)。(填“>”“=”或“<”)
(2)常温下,amLPH=3的CH3COOH与bmLPH=11的NaOH混合,充分反应。
①两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液中粒子浓度从大到小的顺序是 (H2O除外)
(3)常温下,如果取0.1mol/LHA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。试回答以下问题:
①求出混合物中下列算式的计算结果(填具体数字):c(A-)+c(HA)= mol/L; c(OH-)-c(HA)= mol/L。
26、下列有关实验操作或结果的说法中正确的是
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.把三氯化铁溶液蒸干灼烧,最后得到的固体产物是无水三氯化铁
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
25.已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl-)>c(NH4+)>c(H+)>c(OH-)
② c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③ c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④ c(NH4+) =c(Cl-)>c(OH-)=c(H+)
下列说法正确的是
A.若①正确,则溶液中溶质一定为NH4Cl
B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl-)
C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-)
D.溶质不同时,上述四种关系式均可能成立
24、下列叙述正确的是
A.在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7
C.1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8
D.若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则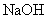 溶液的PH=11
溶液的PH=11
23.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
22、下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com