
4.右图中秦代砖文为“海内皆臣,岁登成熟,道毋饥人,践此万岁”。
其中“海内皆臣”反映的历史信息主要是( )
A.交通发达,水陆并用
B.疆土辽阔,臣民众多
C.国家一统,皇帝集权
D.法律严苛,覆盖全国
3.汉代以来,某地出土了数以千计的青铜重器,青铜铭文多涉及诸侯战争、土地交换等内容。学者推断此地应是 ( )
A.夏人的活动地域 B.周朝的重要都城
 C.秦朝的阿房宫遗址
D.汉初同姓王的封国
C.秦朝的阿房宫遗址
D.汉初同姓王的封国
2.《姓氏起源》一书对“宋”姓的起源解释:周武王克商灭纣,建立周朝,封微子(商王后裔)于商丘,建立宋国,共传36代,亡于楚国。宋亡国后,原王公之族散居各地,以原国“宋”为姓,乃成宋姓。从宋姓起源不能得出的历史信息是 ( )
A.周礼维护中央集权统治 B.诸侯争霸导致宋亡国
C.周朝实行分封制宗法制 D.反映早期政治制度特点
1.下列史实符合西周确立的宗法制继承原则的是 ( )
A.唐太宗通过玄武门之变继位
B.宋太宗继承兄长宋太祖之位
C.明太祖因太子亡指定嫡长孙继位
D.清康熙帝死后皇四子继位
27.(10分)向某起始体积为2L的密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件平衡体系中速率随时间变化的情况,且四个阶段都各改变一个条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
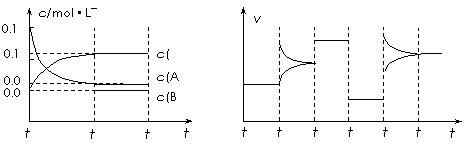
⑴ 若t1 = 15s,则t0-t1阶段以C浓度变化表示的反应速率为v(C) = 。
⑵ 若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆) (填“>”、“=”、“<”)。
⑶ t4-t5阶段改变的条件为 ,B的起始物质的量为 。
⑷t5-t6阶段容器内A的物质的量共减小0.03 mol,而此过程中容器与外界的热交换总量为a kJ,写出该反应的热化学方程式: 。
26.(18分)某研究性学习小组为测定某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:
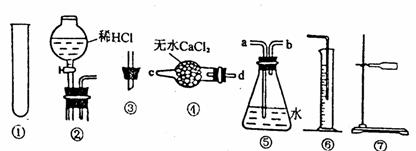
实验一:测定Na2CO3样品中NaHCO3分解放出CO2体积:连接装置的正确顺序是⑦①③④⑤⑥
(1)写出加热时发生反应的化学方程式 。
(2)完成该实验尚缺的仪器是 (填名称);产生气体从装置④的 进入,从装置⑤的 进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(3)应将实验一的装置作哪些调整? 。
(4)当实验一加热至样品不再产生气体时,产生CO2体积为a L(已换算成标况下的体积,下同),则样品中NaHCO3的质量为 ;实验二在加入盐酸至无气体产生时,生成CO2体积为bL ,则Na2CO3样品的纯度为 。
误差分析:
(5)有同学建议将⑤中的水改用饱和的NaHCO3溶液,可以使测定结果更准确,请用平衡移动观点解释: ,同学为何没建议改用Na2CO3饱和溶液?请用离子方程式说明原因: 。
(6)有同学发现在实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值 (填“偏大”、“偏小”或“无影响”)。
25.(10分)
(Ⅰ)已知CaSO4的溶度积为2.5×10-5,如果用0.01 mol·L-1的CaCl2溶液与等体积的Na2SO4溶液混合,若要产生硫酸钙沉淀,则混合前Na2SO4溶液的物质的量浓度至少应为 。
(Ⅱ)在温度T℃下,某稀Ba(OH)2溶液中c(H+)= 10-amol/L,c(OH-) = 10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
1 |
22.00 |
0.00 |
8 |
|
2 |
22.00 |
V |
7 |
|
3 |
22.00 |
22.00 |
6 |
(1)依据题意判断,T 25℃。
(2)b= ,原Ba(OH)2溶液的物质的量浓度为 。
(3)表中V\= 。
24.(16分)海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
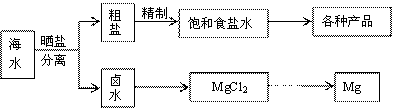
(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100mL0.1 mol/L NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgCl2粗产品。
①粗产品的溶液中含有Na+、Fe3+、Fe2+和Mn2+,需将Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为 ,最终控制溶液的pH值为 。
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
2.7 |
7.6 |
8.3 |
9.6 |
|
沉淀完成 |
3.7 |
9.6 |
9.8 |
11.1 |
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式: 。
 (3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在。几种粒子之间有如下转化关系:
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在。几种粒子之间有如下转化关系:
① 如以途径Ⅰ制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3-与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为 。
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是
23.二元酸H2A在水中发生电离:H2A H++HA-和HA-
H++HA-和HA- H++A2-,则下列物质的水溶液中存在的关系式正确的是 ( )
H++A2-,则下列物质的水溶液中存在的关系式正确的是 ( )
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(A-)>c(H+)
B.Na2A:c(Na+)= 2[c(A2-)+ c(HA-)+ c(H2A)]
C.Na2A:c(H+)+ c(HA-)+ 2c(H2A)= c(OH-)
D.H2A:c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)
22.为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是 ( )
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
A.①③⑤ B.①⑤ C.②④ D.③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com