
4.非金属元素的原子间可形成离子化合物。如:__________、__________、__________等。
例题讲解
例1、A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
① 写出两种元素的名称A__________,B___________
②用结构示意图表示A、B两元素的常见离子。A__________、B________
例2、A、B二种短周期的元素可以形成两种不同的共价化合物C与D。A在化合物C中显-1价,在化合物D中显-2价。化合物C在一定条件下反应产生A的单质。化合物D较为稳定。元素A位于周期表第_______周期,______族;化合物C的电子式______,化合物D的化学式____________。
例3、现有原子序数之和为51的五种短周元素A、B、C、D、E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
①试写出它们的元素符号。
②写出B的氢化物的电子式。
③B的气态氢化物与D的气态氢化物互相作用生成的物质,其电子式为_________或___________.
3.单质分子中的化学键均为非极性键,化合物分子中可有非极键,离子化合物中可存在极性键和非极性键。
各举一例:
2.共价化合物中只有_____________键,离子化合物中一定含有_____________键。
例:
1.共价键可存在于____________________________________________________中。
N2: _____________( ) Cl2:_____________( )
H2O: _____________( )
CO2: _____________( ) CH4:_____________( )
|
项 目 |
概 念 |
对分子的影响 |
|
键 能 |
拆开1摩共价键所吸收的能量或生成1摩共价键所放出的能量 |
键能大、键牢固、分子稳定 |
|
键 长 |
成键的两个原子的核间的平均距离 |
键越短、键能越大,键越牢固,分子越稳定 |
|
键 角 |
分子中相邻键之间的夹角 |
决定分子空间构型和分子的极性 |
定义:____________________________________________化学键叫共价键。
说明:
①成键元素:
_______________________________________________________
②成键原因:
_______________________________________________________。
③_________________________________________________
___________之间形成的共价键称非极性共价键,简称非极性键;___________之间形成的共价键称极性共价键,简称极性共价键。
2.化合物
K2S: _______、 CaO: ___________、 CaF2: ___________
Na2O2: ___________、 CaC2: ___________、 NaOH: ___________
NH4Cl:___________
1.离子
单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;原子团的阳离子:
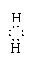
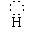
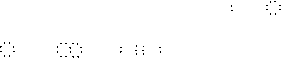
 [H N
H]+、 [H O H]+,单核阴离子:[H ]-、[ O ]2-、[ Cl ]-、;原子团的阴离子:
[H N
H]+、 [H O H]+,单核阴离子:[H ]-、[ O ]2-、[ Cl ]-、;原子团的阴离子:
[ O H]-、[ S S ]2-、[ C C ]2-、[ O O ]2-。
定义:____________________________________________________化学键叫做离子键。
说明:①成键元素:____________________________________________________。
②成键原因:____________________________________________________
③离子键构成离子化合物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com