
2、物体内的分子永不停息地作无规则运动。这是根据布朗运动和扩散现象得出的结论。实验表明扩散的快慢和布朗运动的激烈程度与温度的高低有明显的关系。由此常把大量子的无规则运动称为热运动,热运动是物质运动的一种基本形式,热现象是它的宏观表现。气体分子热运动的平均速率与温度的关系为

常温下,  。
。
1、宏观物体由大量分子组成。分子直径的数量级一般为 ,分子质量为
,分子质量为 。在标准状态下,气体分子的数密度为
。在标准状态下,气体分子的数密度为


1. 4.1、 分子运动论的基本点
1.3.3、混合气体的状态方程
如果有n种理想气体,分开时的状态分别为( 、
、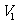 、
、 ),(
),( 、
、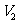 、
、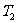 ),…,(
),…,( 、
、 、
、 ),将它们混合起来后的状态为P、V、T,那么,有
),将它们混合起来后的状态为P、V、T,那么,有

如果是两部分气体混合后再分成的部分,则有

例1、一根一端封闭的玻璃管长96cm,内有一段20cm的水银柱。当温度为27C且开口端向上时,被封闭的气柱长60cm。试问温度至少为多少度,水银柱才可从管中全部溢出。
解:设气体温度为T时,管内的水银柱高度为x,x<20cm,大气压强 。
。
 (1)
(1)
得到
 (2)
(2)
其中P以cmHg为单位,长度以cm为单位。
要求x有实数解的条件
400+4×(76×96- )≥0
)≥0
可见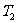 ≤
≤ ,
, ≥
≥ 时,管内气体可以形成平衡状态。反之,T>
时,管内气体可以形成平衡状态。反之,T>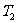 因而x<
因而x< 时,管内气体压强总是(76+x)cmHg,(1)式不再成立,平衡态无法建立而导致非平衡状态,水银柱将全部溢出。
时,管内气体压强总是(76+x)cmHg,(1)式不再成立,平衡态无法建立而导致非平衡状态,水银柱将全部溢出。
例2、设在恒温0℃下,测得三甲胺 的密度随压强变化的数据如下表所示,试根据这些数据要求三甲胺的摩尔质量。
的密度随压强变化的数据如下表所示,试根据这些数据要求三甲胺的摩尔质量。
 |
0.2 |
0.4 |
0.6 |
0.8 |
 |
0.5336 |
1.0790 |
1.6363 |
2.2054 |
解:为了准确测定气体的摩尔质量,必须把实际气体的压强外推到零(P→0)时应用理想气体状态方程,即由(1-15)式有
 (1)
(1)
为了求出P→0时( )的极限值,可将上述数据作如下变换:
)的极限值,可将上述数据作如下变换:
 |
0.2 |
0.4 |
0.6 |
0.8 |
 |
2.6680 |
2.6975 |
2.7272 |
2.7568 |
现以 为纵坐标,P为横作标,作出
为纵坐标,P为横作标,作出 -P图形(图1-3-1),将图中曲线外推到P→0得到
-P图形(图1-3-1),将图中曲线外推到P→0得到


 将上述结果代入(1)式可得
将上述结果代入(1)式可得

即三甲胺的分子量为59.14。
§1.4 气体分子运动论
1、道尔顿分压定律指出:混合气体的压强等于各组分的分压强之和。这条实验定律也只适用于理想气体。即
 (12)
(12)
其中每一部分的气态方程为
 (13)
(13)
混合理想体气状态方程与单一成分的理想气体状态方程形式相同,但M为平均摩尔质量。
 (14)
(14)
由于混合气体的摩尔数应是各组分的摩尔数之和。因此混合气体的平均摩尔质量M有
 (15)
(15)
由(1-20)式和(1-19)式可得混合气体的分压强:
 (16)
(16)
1.3.2、混合理想气体状态方程
3、气体的分合关系:无论是同种还是异种理想气体,将质量为m,状态为PVT的理想气体被分成若干部分( )时,则有
)时,则有
 (11)
(11)
2、气体密度:由(5)式可以得到
 (9)
(9)
例如空气的平均摩尔质量 ,在标准状态下空气密度为
,在标准状态下空气密度为

由(5)式可知,对于理想气体,可应用气态方程的另一形式,为
 (10)
(10)
1.3.1、理想气体状态方程
反映气体在平衡态下状态参量之间规律性联系的关系式称为气态方程。我们知道,理想气体状态方程可在气体实验定律的基础上得到,一定质量的理想气体的两平衡参量之间的关系式为
 (5)
(5)
在标准状态 ,
, ,1mol任何气体的体积
,1mol任何气体的体积 m3mol-1。
m3mol-1。
因此vmol气体在标准状态下的体积为 ,由(5)式可以得出:
,由(5)式可以得出:

由此得到理想气体状态方程或称克拉珀龙方程:

式中R称为摩尔气体恒量,它表示1mol气体在标准状况的 的值,其值为
的值,其值为 
推论:1、1mol的任何物质含有的粒子数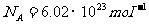 ,这称为阿伏伽德罗常数。设质量为m、摩尔质量为M的气体,其分子数为N,则此气体的摩尔数为
,这称为阿伏伽德罗常数。设质量为m、摩尔质量为M的气体,其分子数为N,则此气体的摩尔数为
 (6)
(6)
同时引用玻耳兹曼常数

k的物理意义:1个分子在标况下的 。
。
将(6)式代入(5)式,可以得到
 (7)
(7)
或者 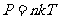 (8)
(8)
1.2.4、理想气体
它是能够准确遵守气体实验定律的一个气体的理论模型。
对查理得律,设P和 分别表示
分别表示 和
和 时气体压强,则有
时气体压强,则有
 ,
,
对盖-吕萨拉定律,设 和
和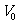 分别表示
分别表示 和
和 时气体的体积,则有
时气体的体积,则有
 ,
,
 对理想气体,有
对理想气体,有

例1、一个质量m=200.0kg、长 =2.00m的薄底大金属桶倒扣在宽旷的水池底部(图1-2-3)桶内的横截面积
=2.00m的薄底大金属桶倒扣在宽旷的水池底部(图1-2-3)桶内的横截面积 (桶的容积为
(桶的容积为 ),桶本身(桶壁与桶底)的体积
),桶本身(桶壁与桶底)的体积 ,桶内封有高度
,桶内封有高度 的空气,池深
的空气,池深 ,大气压强
,大气压强 水柱高,水的密度
水柱高,水的密度 ,重力加速度g取
,重力加速度g取 。若用图中所示吊绳将桶上提,使桶底能到达水面处,则绳拉力所需做的功有一最小值,试求从开始到绳拉力刚完成此功的过程中,桶和水(包括池水和桶内水)的机械能改变了多少(结果要保留三位有效数字)。不计水阻力,设水温很低,不计其饱和蒸气压的影响,并设水温上下均匀且保持不变。
。若用图中所示吊绳将桶上提,使桶底能到达水面处,则绳拉力所需做的功有一最小值,试求从开始到绳拉力刚完成此功的过程中,桶和水(包括池水和桶内水)的机械能改变了多少(结果要保留三位有效数字)。不计水阻力,设水温很低,不计其饱和蒸气压的影响,并设水温上下均匀且保持不变。
解:在上提过程中,桶内空气压强减小,体积将增大,从而对桶和桶内空气(空气质量不计)这一整体的浮力将增大。本题若存在桶所受浮力等于重力的位置,则此位置是桶的不稳定平衡点,再稍上提,浮力将大于重力,桶就会上浮。从这时起,绳不必再拉桶,桶会在浮力作用下,上浮到桶底到达水面并冒出。因此绳对桶的拉力所需做的最小功的过程,就是缓慢地将桶由池底提高到浮力等于重力的位置所历的过程。
 下面先看这一位置是否存在。如果存在的话,如图1-2-4所示,设在此位置时桶内空气的高度为
下面先看这一位置是否存在。如果存在的话,如图1-2-4所示,设在此位置时桶内空气的高度为 ,因浮力等于重力,应有
,因浮力等于重力,应有
 (1)
(1)
代入已知数据可得
 (2)
(2)
设此时桶的下边缘距池底的高度H,由玻--马定律可知
 (3)
(3)
由(2)、(3)式得到
H=12.24m (4)
因为H< ,即整个桶仍浸在水中,可知存在上述浮力等于重力的位置。
,即整个桶仍浸在水中,可知存在上述浮力等于重力的位置。
现在要求将桶由池底缓慢地提高到H处桶及水的机械能的增量△E。△E包括三部分:(1)桶势能的增量 ;(2)在H高时桶本身排开的水可看作下降去填充在池底时桶本身所占空间而引起水势能的增量
;(2)在H高时桶本身排开的水可看作下降去填充在池底时桶本身所占空间而引起水势能的增量 ;(3)在H高度时桶内空气所排开的水,可看作一部分下降去填充在池底时空气所占的空间,由于空气膨胀的那部分上升到水池表面,由此引起水势的增量
;(3)在H高度时桶内空气所排开的水,可看作一部分下降去填充在池底时空气所占的空间,由于空气膨胀的那部分上升到水池表面,由此引起水势的增量 。则
。则
 ;
;
 ;
;
 。
。




§1-3 理想气体状态方程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com