
2.1.2、气体体积功的计算
2.1.1、作功和传热
作功可以改变物体的内能。如果外界对系统作功W。作功前后系统的内能分别为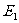 、
、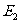 ,则有
,则有
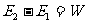
没有作功而使系统内能改变的过程称为热传递或称传热。它是物体之间存在温度差而发生的转移内能的过程。在热传递中被转移的内能数量称为热量,用Q表示。传递的热量与内能变化的关系是
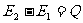
做功和传热都能改变系统的内能,但两者存在实质的差别。作功总是和一定宏观位移或定向运动相联系。是分子有规则运动能量向分子无规则运动能量的转化和传递;传热则是基于温度差而引起的分子无规则运动能量从高温物体向低温物体的传递过程。
1.5.4、重力场中粒子按高度的分布
在重力场中,气体分子受到两种相互对立的作用。无规则的热运动将使气体分子均匀分布于它们所能到达的空间,而重力则要使气体分子聚拢在地面上,当这两种作用达到平衡时,气体分子在空间非均匀分布,分子数随高度减小。根据玻尔兹曼分布律,可以确定气体分子在重力场中按高度分布的规律:
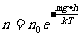
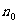 是h=0处单位体积内的分子数,n是高度为h处单位体积内的分子数,n随高度h的增加按指数减小,分子的质量m越大,重力的作用越显著,n的减小就越迅速,气体的温度越高,分子的无规则运动越剧烈,n的减小越缓慢。
是h=0处单位体积内的分子数,n是高度为h处单位体积内的分子数,n随高度h的增加按指数减小,分子的质量m越大,重力的作用越显著,n的减小就越迅速,气体的温度越高,分子的无规则运动越剧烈,n的减小越缓慢。
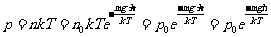
式中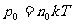 表示h=0处的压强,M为气体的摩尔质量,上式称为气压公式
表示h=0处的压强,M为气体的摩尔质量,上式称为气压公式
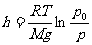
因此测定大气压强随高度而减小的量值,即可确定上升的高度。该式不但适用于地面的大气,还适用于浮悬在液体中的胶体微粒按高度的分布。
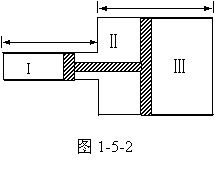 例1、横截面积为S和αS(α>1),长度相同的两圆柱形“对接”的容器内盛有理想气体,每个圆筒中间位置有一个用硬杆想连的活塞,如图1-5-2所示。这时舱Ⅰ内气体压强为
例1、横截面积为S和αS(α>1),长度相同的两圆柱形“对接”的容器内盛有理想气体,每个圆筒中间位置有一个用硬杆想连的活塞,如图1-5-2所示。这时舱Ⅰ内气体压强为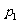 ,舱Ⅲ内气体压强为
,舱Ⅲ内气体压强为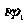 ,活塞处于平衡,整个系统吸收热量Q,温度上升,使各舱温度相同。试求舱Ⅰ内压强的变化。1mol气体内能为CT(C是气体摩尔热容量),圆筒和活塞的热容量很小,摩擦不计。
,活塞处于平衡,整个系统吸收热量Q,温度上升,使各舱温度相同。试求舱Ⅰ内压强的变化。1mol气体内能为CT(C是气体摩尔热容量),圆筒和活塞的热容量很小,摩擦不计。
解:设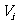 、
、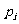 、
、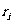 分别为第i个舱内气体的体积、压强的摩尔数。容器内气体总摩尔数
分别为第i个舱内气体的体积、压强的摩尔数。容器内气体总摩尔数 ,因为各舱温度皆为T,利用克拉珀龙方程得
,因为各舱温度皆为T,利用克拉珀龙方程得
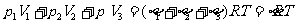 ①
①
取得中打斜线的活塞与硬杆为研究对象,由平衡条件得
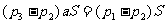 ②
②
而由题意 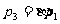 ③
③
及 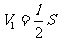 、
、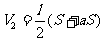 、
、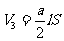
得
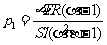 ④
④
系统吸收热量后,假设活塞不移动,显然Ⅰ、Ⅱ、Ⅲ舱气体都作等容升温变化,因题中明确三舱升高的温度相同,因而由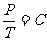
可知三舱气体的压强都增加相同的倍数,即方程②仍然满足,这说明升温过程中活塞确实不移动,即方程④也仍然成立。
因

结合④式易得Ⅰ舱内气体压强的变化
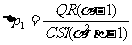 。
。
说明利用②式和③式可得 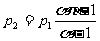
显然只有当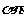 >1时才有意义。因为压强必须为正值。
>1时才有意义。因为压强必须为正值。
1.5.3、物体的势能
由于分子间存在相互作用而具有的能量叫做分子势能。当分子间距离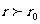 (
(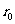 为分子力为零的位置)时,分子力是引力
为分子力为零的位置)时,分子力是引力 ,随着分子间距离r的增大,分子势能减小,故
,随着分子间距离r的增大,分子势能减小,故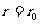 处,分子势能最小。而在
处,分子势能最小。而在 时,由于分子间的作用力可略,故分子势能变为零,如以无穷远处为势能的零点,定性的分子势能曲线可用图1-5-1表示
时,由于分子间的作用力可略,故分子势能变为零,如以无穷远处为势能的零点,定性的分子势能曲线可用图1-5-1表示
1.5.2、理想气体的内能
通常,分子的无规则运动表现为分子的平动和转动等形式。对于单原子分子(如He等)的理想气体来说,分子只有平动动能,其内能应是分子数与分子平均平动动能的乘积,即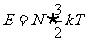 。对于双原子分子(如
。对于双原子分子(如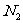 、
、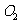 )的理想气体来说,在常温下,分子运动除平动外还可以有转动,分子的平均动能为
)的理想气体来说,在常温下,分子运动除平动外还可以有转动,分子的平均动能为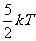 ,其内能
,其内能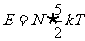 ,因此,理想气体的内能可以表达为
,因此,理想气体的内能可以表达为
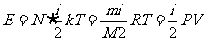
注意: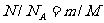 ,
,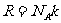 ;对于原单原子分子气体
;对于原单原子分子气体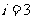 ,对于双原子分子气体
,对于双原子分子气体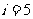 。
。
一定质量的理想气体的内能改变量:
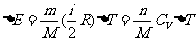
此式适用于一定质量理想气体的各种过程。不论过程如何,一定质量理想气体的内能变不变就看它的温度变不变。式中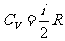 ,表示1mol的理想气体温度升高或降低1K所增加或减少的内能。
,表示1mol的理想气体温度升高或降低1K所增加或减少的内能。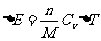 是可以变成
是可以变成
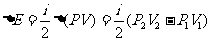
1.5.1、物体的内能
(1)自由度:即确定一个物体的位置所需要的独立坐标系数,如自由运动的质点,需要用三个独立坐标来描述其运动,故它有三个自由度。
分子可以有不同的组成。如一个分子仅由一个原子组成,称为单原子(例:He等),显然它在空间运动时具有三个平动自由度。
如一个分子由两个原子组成,称为双原子(例: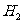 等),双原子分子内的两个原子由一个键所连接,确定两个原子共同质心的位置,需三个自由度,确定连键的位置,需两个自由度,即双原子分子共有五个自由度。而对三原子分子(例:
等),双原子分子内的两个原子由一个键所连接,确定两个原子共同质心的位置,需三个自由度,确定连键的位置,需两个自由度,即双原子分子共有五个自由度。而对三原子分子(例: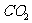 等),除了具有三个平动自由度、两个转动自由度外,还有一个振动自由度,即共计有六个自由度。
等),除了具有三个平动自由度、两个转动自由度外,还有一个振动自由度,即共计有六个自由度。
(2)物体中所有分子热运动的动能和分子势能的总和称为物体的内能。由于分子热运动的平均动能跟温度有关,分子势能跟体积有关。因此物体的内能是温度和体积的函数。
理想气体的分子之间没有相互作用,不存在分子势能。因此理想气体的内能是气体所有分子热运动动能的总和,它只跟气体的分子数和温度有关,与体积无关。
1.4.4、温度的微观意义
将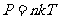 式代入
式代入 式后,可以得到气体分子的平均平动动能为
式后,可以得到气体分子的平均平动动能为
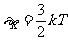
这被称为气体温度公式,温度升高,分子热运动的平均平动动能增大,分子热运动加剧。因此,气体的温度是气体分子平均平动能的标志,是分子热运动剧烈程度的量度。
 例1、质量为
例1、质量为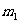 的圆筒水平地放置在真空中。质量
的圆筒水平地放置在真空中。质量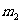 、厚度可忽略的活塞将圆筒分为体积相同的两部分(图1-4-1),圆筒的封闭部分充有n摩尔的单原子理想气体,气体的摩尔质量为M,温度为
、厚度可忽略的活塞将圆筒分为体积相同的两部分(图1-4-1),圆筒的封闭部分充有n摩尔的单原子理想气体,气体的摩尔质量为M,温度为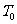 ,突然放开活塞,气体逸出。试问圆筒的最后速度是多少?设摩擦力、圆筒和活塞的热交换以及气体重心的运动均忽略不计。(
,突然放开活塞,气体逸出。试问圆筒的最后速度是多少?设摩擦力、圆筒和活塞的热交换以及气体重心的运动均忽略不计。(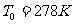 ,
,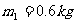 ,
,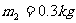 ,
,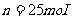 氦的摩尔质量为
氦的摩尔质量为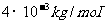 ,
,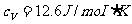 ,
,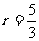 )
)
解:过程的第一阶段是绝热膨胀,膨胀到两倍体积后(图1-4-2)温度将是T。根据绝热方程,有
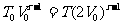
因此:
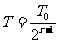
圆筒和活塞的总动能等于气体内能的损失,即
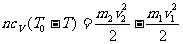
根据动量守恒定律,
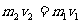
解上述方程,得过程第一阶段结束时的圆筒速度:
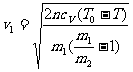 。
。
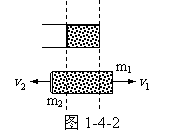 由此得出结论,在过程第一阶段的最后瞬间,圆筒以速度
由此得出结论,在过程第一阶段的最后瞬间,圆筒以速度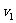 向右运动,此时活塞正好从圆筒冲出。
向右运动,此时活塞正好从圆筒冲出。
我们把坐标系设置在圆筒上。所给的是一个在真空中开口的圆筒,筒内贮有质量为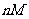 、温度为T的气体。显然,气体将向左上方流动,并推动圆筒向右以速度
、温度为T的气体。显然,气体将向左上方流动,并推动圆筒向右以速度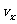 运动。气体分子的动能由下式给出:
运动。气体分子的动能由下式给出:
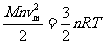
式中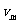 是分子的平均速度[注:指均方根速率],它由下述关系给定:
是分子的平均速度[注:指均方根速率],它由下述关系给定: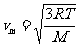
平衡状态下各有1/6的分子在坐标轴方向来回运动。在计算气体逸出时,假定有1/6的分子向圆筒的底部运动。这自然只是一级近似。因此,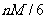 的质量以速度
的质量以速度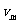 向圆筒底部运动,并与筒底弹性碰撞,之后圆筒以速度
向圆筒底部运动,并与筒底弹性碰撞,之后圆筒以速度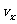 、气体以速度
、气体以速度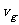 运动。对于弹性碰撞,动量守恒定律和机械守恒定律成立。由动量守恒有
运动。对于弹性碰撞,动量守恒定律和机械守恒定律成立。由动量守恒有
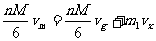
由机械能守恒有 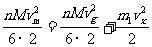
解以上方程组,得到气体逸出后的圆筒速度为
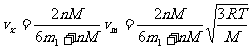
气体分子的1/6以速度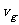 反弹回来,
反弹回来,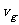 的绝对值要小于
的绝对值要小于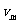 。
。
气体必然有较低的温度,其一部分内能使圆筒的动能增加。速度相加后得圆筒速度为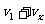 。代入所给的数据:
。代入所给的数据:
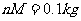 ;
;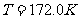 ;
;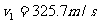 ;
;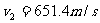
 ;
;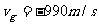 ;
;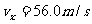 .
.
得圆筒的最后速度为
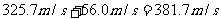
§1.5 理想气体的内能
1.4.3、理想气体的压强
宏观上测量的气体施给容器壁的压强,是大量气体分子对器壁不断碰撞的结果。在通常情况下,气体每秒碰撞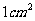 的器壁的分子数可达
的器壁的分子数可达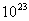 。在数值上,气体的压强等于单位时间内大量分子施给单位面积器壁的平均冲量。
。在数值上,气体的压强等于单位时间内大量分子施给单位面积器壁的平均冲量。
其表达式为

式中n是分子数密度,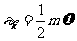 是分子的平均平动动能,n和
是分子的平均平动动能,n和 增大,意味着单位时间内碰撞单位面积器壁的分子数增多,分子碰撞器壁一次给予器壁的平均冲量增大,因而气体的压强增加。
增大,意味着单位时间内碰撞单位面积器壁的分子数增多,分子碰撞器壁一次给予器壁的平均冲量增大,因而气体的压强增加。
1.4.2、理想气体的微观模型
先来作个估算:在标准状态下,1mol气体体积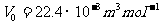 ,分子数
,分子数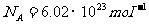 ,若分子直径
,若分子直径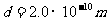 ,则分子间的平均间距
,则分子间的平均间距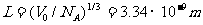 ,相邻分子间的平均间距与分子直径相比
,相邻分子间的平均间距与分子直径相比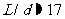 。
。
由此可知,气体分子间的距离比较大,在处理某些问题时,可以把气体分子视为没有大小的质点;同时可以认为气体分子除了相互碰撞或者跟器壁碰撞之外,分子力也忽略不计,分子在空间自由移动,也没有分子势能。因此理想气体是指分子间没有相互作用和分子可以看作质点的气体。这一微观模型与气体愈稀薄愈接近于理想气体的宏观概念是一致的。
3、分子之间存在的相互作用力。分子之间同时存在引力和斥力,它们都随距离的增大而减小。其合力具体表现为相吸引还是相排斥,取决于分子间的距离。当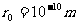 时,合力为零,分子间的距离
时,合力为零,分子间的距离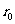 的位置称为平衡位置;当r>
的位置称为平衡位置;当r>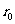 时,分子力表现引力;当r<
时,分子力表现引力;当r<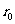 时,分子力表现为斥力;当r>
时,分子力表现为斥力;当r>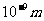 时,分子力可忽略不计。分子力是保守力,存在着由分子和分子间相对位置所决定的势能称为分子力势能。
时,分子力可忽略不计。分子力是保守力,存在着由分子和分子间相对位置所决定的势能称为分子力势能。
分子力和热运动是决定物体宏观性质的基本因素。分子力作用倾向于使分子聚集一起,在空间形成某种有序排列;热运动却力图造成混乱存在向外扩散的趋势。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com