

2.2.5、其他过程
理想气体的其他过程,可以灵活地运用下列关系处理问题。
气态方程: 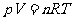
热力学第一定律: 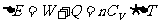
功:W=±(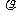 -V图中过程曲线下面积)
-V图中过程曲线下面积)
过程方程:由过程曲线的几何关系找出过程的P-V关系式。若某理想气体经历V-T图中的双曲线过程,其过程方程为:
VT=C 或者 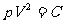
2.2.4、绝热过程
气体始终不与外界交换热量的过程称之为绝热过程,即Q=0。例如用隔热良好的材料把容器包起来,或者由于过程进行得很快来不及和外界发生热交换,这些都可视作绝热过程。
理想气体发生绝热变化时,p、V、T三量会同时发生变化,仍遵循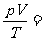 恒量。根据热力学第一定律,因Q=0,有
恒量。根据热力学第一定律,因Q=0,有
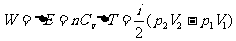
这表明气体被绝热压缩时,外界所作的功全部用来增加气体内能,体积变小、温度升高、压强增大;气体绝热膨胀时,气体对外做功是以减小内能为代价的,此时体积变大、温度降低、压强减小。气体绝热膨胀降温是液化气体获得低温的重要方法。
例:0.020kg的氦气温度由17℃升高到27℃。若在升温过程中,①体积保持不变,②压强保持不变;③不与外界交换热量。试分别求出气体内能的增量,吸收的热量,外界对气体做的功。
气体的内能是个状态量,且仅是温度的函数。在上述三个过程中气体内能的增量是相同的且均为:
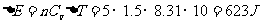
①
① 等容过程中  ,
,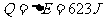
②
② 在等压过程中 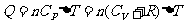
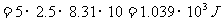
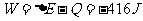
③
③ 在绝热过程中 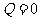 ,
,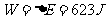
1mol温度为27℃的氦气,以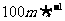 的定向速度注入体积为15L的真空容器中,容器四周绝热。求平衡后的气体压强。
的定向速度注入体积为15L的真空容器中,容器四周绝热。求平衡后的气体压强。
平衡后的气体压强包括两部分:其一是温度27℃,体积15L的2mol氦气的压强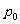 ;其二是定向运动转向为热运动使气体温度升高△T所导致的附加压强△p。即有
;其二是定向运动转向为热运动使气体温度升高△T所导致的附加压强△p。即有
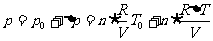
氦气定向运动的动能完全转化为气体内能的增量:
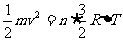
∴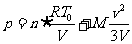
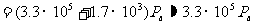
2.2.3、等温过程
气体在等温过程中,有pV=恒量。例如,气体在恒温装置内或者与大热源想接触时所发生的变化。
理想气体的内能只与温度有关,所以理想气体在等温过程中内能不变,即△E=0,因此有Q=-W。即气体作等温膨胀,压强减小,吸收的热量完全用来对外界做功;气体作等温压缩,压强增大,外界的对气体所做的功全部转化为对外放出的热量。
2.2.1、等压过程
气体在等压过程中,有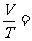 恒量,如容器中的活塞在大气环境中无摩擦地自由移动。
恒量,如容器中的活塞在大气环境中无摩擦地自由移动。
根据热力学第一定律可知:气体等压膨胀时,从外界吸收的热量Q,一部分用来增加内能,温度升高,另一部分用于对外作功;气体等压压缩时,外界对气体做的功和气体温度降低所减少的内能,都转化为向外放出的热量。且有
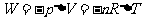
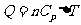
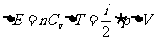
定压摩尔热容量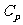 与定容摩尔热容量
与定容摩尔热容量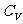 的关系有
的关系有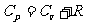 。该式表明:1mol理想气体等压升高1K比等容升高1k要多吸热8.31J,这是因为1mol理想气体等压膨胀温度升高1K时要对外做功8.31J的缘故。
。该式表明:1mol理想气体等压升高1K比等容升高1k要多吸热8.31J,这是因为1mol理想气体等压膨胀温度升高1K时要对外做功8.31J的缘故。
2.2.1、等容过程
气体等容变化时,有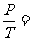 恒量,而且外界对气体做功
恒量,而且外界对气体做功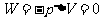 。根据热力学第一定律有△E=Q。在等容过程中,气体吸收的热量全部用于增加内能,温度升高;反之,气体放出的热量是以减小内能为代价的,温度降低。
。根据热力学第一定律有△E=Q。在等容过程中,气体吸收的热量全部用于增加内能,温度升高;反之,气体放出的热量是以减小内能为代价的,温度降低。
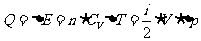
式中 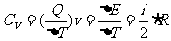 。
。
2.1.5、气体的自由膨胀
气体向真空的膨胀过程称为气体的自由膨胀。气体自由膨胀时,没有外界阻力,所以外界不对气体做功W=0;由于过程进行很快,气体来不及与外界交换热量,可看成是绝热过程Q=0;根据热力学第一定律可知,气体绝热自由膨胀后其内能不变,即△E=0。
如果是理想气体自由膨胀,其内能不变,气体温度也不会变化,即△T=0;如果是离子气体自由膨胀,虽内能不变,但分子的平均斥力势能会随着体积的增大而减小,分子的平均平动动能会增加,从而气体温度会升高,即△T>0;如果是存在分子引力的气体自由膨胀后,其内能不变,但平均分子引力势能会增大,分子平均平动动能会减小,气体温度会降低,即△T<0。
例1、绝热容器A经一阀门与另一容积比A的容积大得多的绝热容器B相连。开始时阀门关闭,两容器中盛有同种理想气体,温度均为30℃,B中气体的压强是A中的两倍。现将阀门缓慢打开,直至压强相等时关闭。问此时容器A中气体的温度为多少?假设在打开到关闭阀门的过程中处在A中的气体与处在B中的气体之间无热交换。已知每摩尔该气体的内能为E=2.5RT。
分析:因为B容器的容积远大于A的容积,所以在题述的过程中,B中气体的压强和温度均视为不变。B容器内部分气体进入A容器,根据题设,A容器内气体是个绝热过程。外界(B容器的剩余气体)对A气体做功等于其内能的增量,从而求出A气体的最终温度。
解:设气体的摩尔质量为M,A容器的体积V,打开阀门前,气体质量为m,压强为p,温度为T。打开阀门又关闭后,A中气体压强为2p,温度为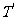 ,质量为
,质量为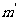 ,则有
,则有
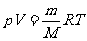 ,
, 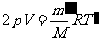
进入A气体质量 ,设这些气体处在B容器中时所占体积为
,设这些气体处在B容器中时所占体积为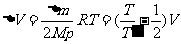 。为把这些气体压入A容器,B容器中其他气体对这些气体做的功为
。为把这些气体压入A容器,B容器中其他气体对这些气体做的功为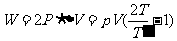 。A中气体内能的变化
。A中气体内能的变化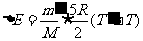 。根据热力学第一定律有
。根据热力学第一定律有
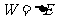
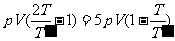
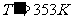
例2、一根长为76cm的玻璃管,上端封闭,插入水银中。水银充满管子的一部分。 封闭体积内有空气
封闭体积内有空气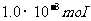 ,如图2-1-6所示,大气压为76cmHg。空气的摩尔定容热容量
,如图2-1-6所示,大气压为76cmHg。空气的摩尔定容热容量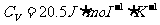 ,当玻璃管温度降低10℃时,求封闭管内空气损失的热量。
,当玻璃管温度降低10℃时,求封闭管内空气损失的热量。
分析:取封闭在管内的空气为研究对象,为求出空气在降温过程中的放热,关键是确定空气在降温过程中遵循的过程方程。由于管内空气压强p等于大气压强与管内水银柱压强之差,因管长刚好76cm,故P与空气柱高度成正比,即封闭气体的压强与其体积成正比。随着温度降低,管内水银柱上升,空气的压强与体积均减小,但仍保持正比关系。
解:设在降温过程中管内封闭空气柱的高度为h,水银柱高度为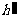 ,则
,则 。管内封闭空气的压强为
。管内封闭空气的压强为
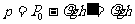
式中ρ为水银密度,上式表明,在降温过程中,空气的压强p与空气柱高度h成正比,因管粗细均匀,故p与空气体积V成正比,即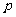 ∝V
∝V
这就是管内封闭空气在降温过程中所遵循的过程方程。
空气在此过程中的摩尔热容量 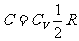 。
。
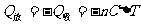
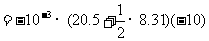
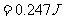
本题也可直接由热力学第一定律求解,关键要求得空气膨胀做功。由题给数据,可分析得空气对水银柱做功是线性力做功的情形。
§2.2 热力学第一定律对理想气体的应用
2.1.4、 热量
当一个热力学系统与温度较高的外界热接触时,热力学系统的温度会升高,其内能增加,状态发生了变化。在这个状态变化的过程中,是外界把一部分内能传递给了该系统,我们就说系统从外界吸收了热量。如果系统与外界没有通过功来交换能量,系统从外界吸收了多少热量,它的内能就增加多少。热量是过程量。
做功和传递热量都可以使系统的内能发生变化,但它们本质上是有区别的,做功是通过物体的宏观位移来完成的,是通过有规则的运动与系统内分子无规则运动之间的转换,从而使系统的内能有所改变;传递热量是通过分子之间的相互作用来完成的,是系统外物体分子无规则运动与系统内分子无规则运动之间的传递,从而使系统的内能有所改变。为了区别起见,我们把热量传递叫做微观功。
2.1.3、热力学第一定律
当系统与外界间的相互作用既有做功又有热传递两种方式时,设系统在初态的内能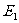 ,经历一过程变为末态的内能
,经历一过程变为末态的内能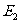 ,令
,令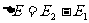 。在这一过程中系统从外界吸收的热量为Q,外界对系统做功为W,则△E=W+Q。式中各量是代数量,有正负之分。系统吸热Q>0,系统放热Q<0;外界做功W>0,系统做功W<0;内能增加
。在这一过程中系统从外界吸收的热量为Q,外界对系统做功为W,则△E=W+Q。式中各量是代数量,有正负之分。系统吸热Q>0,系统放热Q<0;外界做功W>0,系统做功W<0;内能增加
△E>0,内能减少△E<0。热力学第一定律是普遍的能量转化和守恒定律在热现象中的具体表现。
2、功
在热力学中,一般不考虑整体的机械运动。热力学系统状态的变化,总是通过做功或热传递或两者兼施并用而完成的。在力学中,功定义为力与位移这两个矢量的标积。在热力学中,功的概念要广泛得多,除机械功外,主要的有:流体体积变化所作的功;表面张力的功;电流的功。
 (1)机械功
(1)机械功
有些热力学问题中,应考虑流体的重力做功。如图2-1-1所示,一直立的高2h的封闭圆筒,被一水平隔板C分成体积皆为V的两部分。其中都充有气体,A的密度 较小,B的密度
较小,B的密度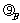 较大。现将隔板抽走,使A、B气体均匀混合后,重力对气体做的总功为
较大。现将隔板抽走,使A、B气体均匀混合后,重力对气体做的总功为
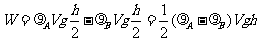
 (2)流体体积变化所做的功
(2)流体体积变化所做的功
我们以气体膨胀为例。设有一气缸,其中气体的压强为P,活塞的面积S(图2-1-2)。当活塞缓慢移动一微小距离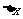 时,在这一微小的变化过程中,认为压强P处处均匀而且不变,因此是个准静态过程。气体对外界所作的元功
时,在这一微小的变化过程中,认为压强P处处均匀而且不变,因此是个准静态过程。气体对外界所作的元功 ,外界(活塞)对气体做功
,外界(活塞)对气体做功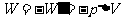 ,当气体膨胀时
,当气体膨胀时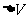 >0,外界对气体做功W<0;气体压缩时
>0,外界对气体做功W<0;气体压缩时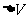 <0,外界对气体做功W>0。
<0,外界对气体做功W>0。
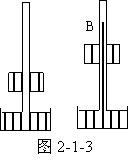
如图2-1-3所示的A、B是两个管状容器,除了管较粗的部分高低不同之外,其他一切全同。将两容器抽成真空,再同时分别插入两个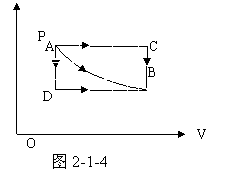 水银池中,水银沿管上升。大气压强皆为P,进入管中水银体积皆为V,所以大气对两池中水银所做功相等,但由于克服重力做功A小于B,所以A管中水银内能增加较多,其温度应略高。
水银池中,水银沿管上升。大气压强皆为P,进入管中水银体积皆为V,所以大气对两池中水银所做功相等,但由于克服重力做功A小于B,所以A管中水银内能增加较多,其温度应略高。
准静态过程可用p-V图上一条曲线来表示,功值W为p-V图中过程曲线下的面积,当气体被压缩时W>0。反之W<0。如图2-1-4所示的由A态到B态的三种过程,气体都对外做功,由过程曲线下的面积大小可知:ACB过程对外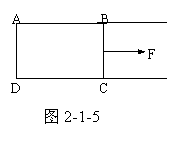 功最大,AB次之,ADB的功最小。由此可知,在给定系统的初态和终态,并不能确定功的数值。功是一个过程量,只有当系统的状态发生变化经历一个过程,才可能有功;经历不同的过程,功的数值一般而言是不同的。
功最大,AB次之,ADB的功最小。由此可知,在给定系统的初态和终态,并不能确定功的数值。功是一个过程量,只有当系统的状态发生变化经历一个过程,才可能有功;经历不同的过程,功的数值一般而言是不同的。
(3)表面张力的功
液面因存在表面张力而有收缩趋势,要加大液面就得作功。设想一沾有液膜的铁丝框ABCD(图2-1-5)。长为 2αl的力作用在BC边上。要使BC移动距离△x,则外力F作的功为
W=F△x=2αl△x=α△S。
式中α为表面张力系数,α指表面上单位长度直线两侧液面的相互拉力,△S指BC移动中液膜两个表面面积的总变化。外力克服表面张力的功转变为液膜的表面能。
由此可见,作功是系统与外界相互作用的一种方式,也是两者的能量相互交换的一种方式。这种能量交换的方式是通过宏观的有规则运动来完成的。我们把机械功、电磁功等统称为宏观功。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com