
20.[江苏省启东中学2009届高三阶段调研测 ]向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)[ CD ]


A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.2)图显示M中c(NaHCO3)>c(Na2CO3)
D.(4)图显示M中c(NaHCO3)>c(Na2CO3)
19.[江苏省启东中学2009届高三阶段调研测 ]今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是[ AC ]
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-可能存在 D Ba2+一定不存在,Mg2+可能存在
18.[江苏省启东中学2009届高三阶段调研测 ](10分)(1)某一反应体系中有反应物和生成物共5种物质: 、
、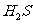 、
、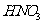 、
、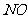 、
、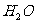 。该反应中还原产物是______;若反应过程中转移了0.3
。该反应中还原产物是______;若反应过程中转移了0.3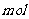 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______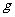 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
① 当 a / b =1时____________________________________________;
② 当a / b≥3/2时____________________________________________。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O NH4+ +
OH_
NH4+ +
OH_
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
_______________________________________________
(B)N2H4是二元弱碱,试写出其第二步电离方程式
_______________________________________________
答案.(1)NO 4.8g (2) ①2Cl2 + 2Fe2+ + 2Br- = 4Cl- + 2Fe3+ + Br2
②3Cl2 + 2Fe2+ + 4Br- =2Fe3+ + 2Br2 + 6Cl-
(3)B(OH)3+H2O B(OH)4- + H+ N2H5+
+H2O
B(OH)4- + H+ N2H5+
+H2O N2H62+ + OH_
N2H62+ + OH_
17.[江苏省启东中学2009届高三阶段调研测 ](8分)2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度。
答案.(8分)n[Fe(NO3)3]=n(I-)= 0.2 mol·L-1 ×0.100L=0.020mol (1分)
n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]= -0.020mol=0.030mol (1分)
-0.020mol=0.030mol (1分)
根据电子守衡:n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2=n(NO)×3
即:0.020mol×3+0.030mol×2= n(NO)×3 ∴ n(NO)=0.040mol(2分)
根据氮元素守衡:n(HNO3)= n(NO)+ n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2
=0.040mol+0.020mol×3+0.030mol×2=0.16mol(2分)
c(HNO3)= (2分)
(2分)
4.66g,且甲不溶于稀盐酸;
Ⅱ.取另一份R的水溶液与过量的NaOH
溶液混合加热,生成具有刺激性气味的气
体乙0.224L(标准状况),乙能使湿润的
红色石蕊试纸变蓝。据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
①B点处溶液中离子浓度从大到小的顺序是 。
②R溶液的物质的量浓度为 。
③BC段表示的含义是 。
④CD段表示的含义是 。
答案.(1)NH4Al(SO4)2(1分);BaSO4(1分)
(2)c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)(2分);2mol/L(2分)
NH4+与OH-生成NH3·H2O(1分)
Al(OH)3与NaOH反应,沉淀逐渐溶解(1分)
16.[江苏省启东中学2009届高三阶段调研测 ](8分)盐R的化学式为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液进行如下实验:
 Ⅰ.取一份R的水溶液与过量的Ba(OH)2
Ⅰ.取一份R的水溶液与过量的Ba(OH)2
溶液反应,反应过程中生成白色沉淀,沉
淀量先增加后减少,最终剩余沉淀甲
15.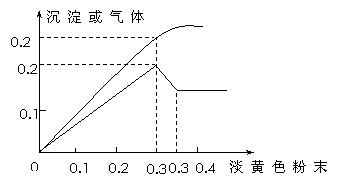 [江苏省启东中学2009届高三阶段调研测 ](8分)有一元色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
[江苏省启东中学2009届高三阶段调研测 ](8分)有一元色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
(1)溶液中肯定没有_____________离子。
(2)溶液中离子的物质的量之比为_________________________________。
(3)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为____________________________________。
答案.(8分)(1)Fe3+、Cu2+ (2分) (2)Mg2+︰NH4+︰Al3+=1︰1︰1(2分)
(3)①2Na2O2+2H2O = 4NaOH+O2↑(2分) ②Al(OH)3+OH- = AlO2-+2H2O (2分)
13.[江苏省南通市2009届高三期中检测11月]50g含有1.17g氯化钠和0.84g氟化钠的溶液中加入过量的硝酸银溶液,充分反应搅拌、静止、过滤、洗涤、干燥得到2.87g固体,由此得出的结论是 [ D]
A.氯离子只有一部分参加反应 B.氟离子只有一部分参加反应
C.氟化银难溶于水 D.氟化钠和硝酸银在溶液中无沉淀生成
14[江苏省南通市2009届高三期中检测11月].NA表示阿伏加德罗常数的值,下列说法正确的是[ D]
A.铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积为11.2L
B.通常状况下将0.5molHI气体和0.5molCl2混合后,气体的分子数为NA
C.标准状况下0.5NA个Br2所占的体积约为11.2L
D.53gNa2C03固体含有的离子数为1.5NA
12.[江苏省南通市2009届高三期中检测11月]在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14将该气体与2.24L氧气(标准状况)充分反应后的产物通过足量的Na202粉末,使Na202粉末增重的质量为[B ]
A.等于6.72g B.小于6.72g C.大于6.72g D.无法计算
11.[江苏省南通市2009届高三期中检测11月] (6分)已知固体混合物A由NaHC03、KHC03、MgC3、CaC03四种物质中的两种混合而成,通过计算和推理回答下列问题:
(1)取A与足量的盐酸反应
①若n(A)为定值,生成气体的量即为定值,则A的组成最多可能有 种。
②若m(A)为定值,生成气体的量即为定值,则A的可能组成是 ; ; 。(可以不填满,也可以补充)
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,则n(A)= mol.
答案.(1)①6 ②MgCO3,NaHC03;KHC03,CaC03
(2)O.200
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com