
4.[ 连云港新海高级中学09届高三化学九月质量检查试题](10分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
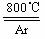 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2 TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
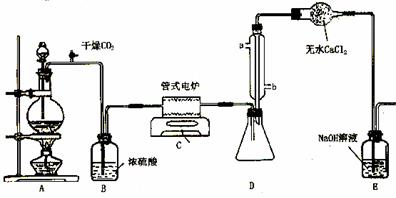
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
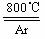 TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
答案.)⑴ ③①④② (2分)
② MnO2+4H+
+2 Cl- Mn2+ + Cl2↑+2H2O
(2分)
Mn2+ + Cl2↑+2H2O
(2分)
⑵ 排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解 (1分)
⑶ b (1分),⑷吸收多余的Cl2,以免污染空气(1分)
⑸TiCl4 + 4H2O == 4HCl + Ti(OH)4(2分) ⑹防止Mg和Ti被空气中氧气氧化 (2分)
3.[连云港新海高级中学09届高三化学九月质量检查试题](10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
程式:
 A12Te3 + ( ) A1(OH)3↓ + H2Te↑
A12Te3 + ( ) A1(OH)3↓ + H2Te↑
(6)右图所示为氧族元素单质与H2反应过程中的能
量变化示意图,其中a、b、c、d分别表示氧族中某
一元素的单质,△E为相同物质的量的单质与H2反应
过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
答案. (1)113 - 450℃; (1分) (2)-2、+4、+6; (1分)
(3)H2Te>H2Se>H2S; (1分)
(4)还原性 (1分) 2H2Se + O2 == 2H2O + 2Se; (2分)
 (5)A12Te3
+ ( 6H2O) 2A1(OH)3↓
+3H2Te↑ (2分)
(5)A12Te3
+ ( 6H2O) 2A1(OH)3↓
+3H2Te↑ (2分)
(6)硫 (1分) 碲 (1分)
2.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](11分)
⑴ 下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是 (填编号)。
⑵ 某同学为验证苯的沸点(80.1℃)比水低,以试管取用少量的苯放在水浴中,并在水浴中插一温度计。实验开始后,用酒精灯给水浴加热。
该实验有一个明显的缺点。指出这个缺点,并说明如何改进。
。
⑶ 为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:
_ _
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。
当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜极所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出):____________________________________________________ __ 。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表
现为:__________________________________________________ 。
答案.(1)①③⑤(2分,漏选得1分,多选0分)
(2)苯挥发造成空气污染(1分),应在试管上加一单孔塞,孔中插一长直导管(1分)
(3)Fe3+>Cu2+>H+>Fe2+ (2分)
2Fe3++2e-=2Fe2+; Cu2++2e-=Cu ; 2H++2e-=H2↑; (3分)
①有污染性气体Cl2 产生 ② 使用了电解装置,成本较高;等。(2分)
1.[江苏省赣榆高级中学2009年高考双周模拟试卷 ] (7分)
江苏宝胜集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:

 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生
反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:

(1)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(2)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法:
。
(3)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
答案.(1)乙 。甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。(关键词:“污染空气”)
(2)“确保CuSO4 用完”或“将Cu完全置换出来”,其他类似说法均可。
将所得铜粉酸洗后再洗涤、干燥;或过滤前在加适量的酸以除去剩余的铁粉。
(3)蒸发 、降温 。 水污染或环境污染。
33. (江苏省栟茶09高三化学测试卷11月)已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是 [C]
A.上述实验证明还原性:MnO-4>Cl2>Fe3+>I2 B.上述实验中,共有两个氧化还原反应 C.实验①生成的气体能使湿润的淀粉KI试纸变蓝 D.实验②证明Fe2+既有氧化性又有还原性


32.(江苏省栟茶09高三化学测试卷11月)下列实验操作正确的是[B]
A.用100mL容量瓶准确量取100mL溶液
B.中和滴定前,锥形瓶用蒸馏水荡洗后直接装入待测液
C.用稀硫酸洗涤久置石灰水的试剂瓶
D.用pH试纸蘸取稀盐酸,取出与标准比色卡对比
31.(江苏省栟茶09高三化学测试卷11月)用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是[BC]
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝的熔点高 D.用酸处理时未能将氧化铝溶解
30.(江苏省栟茶09高三化学测试卷11月)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为_____ ___色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=____ ___。
答案..⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解 ⑵过滤、洗涤
⑶100mL容量瓶、酸式滴定管 (紫)红 ⑷3
30. (江苏省海安县2009届高三年级期初调研考试)某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,Br2被还原,由此推断该溶液中[C ]
(江苏省海安县2009届高三年级期初调研考试)某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,Br2被还原,由此推断该溶液中[C ]
A.不含NO3-,含Fe3+ B.含有NO3-、I-、Cl-
C.含I-,但不能确定是否含Cl- D.含有Fe3+
29.(江苏省海安县2009届高三年级期初调研考试) 金属镁在二氧化碳中燃烧生成MgO和C,将一定量金属镁在含二氧化碳、氧气的混合气体中燃烧后得到的固体,加入足量盐酸中,充分反应后,将溶液蒸干,然后隔绝空气灼烧,得到的固体成分可能是 [AB ]
A.MgO和C B. MgO
C.MgCl2和C D. Mg(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com