
14.{江苏省赣榆高级中学09高三年级十二月 }(B)[实验化学]
甲基橙和酚酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
 步骤Ⅰ 把0.1 g甲基橙和0.1
g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
步骤Ⅰ 把0.1 g甲基橙和0.1
g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
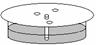
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。在距滤纸中心约1cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
⑴本实验采用的分离方法叫_________,若分离淀粉胶体与氯化钠的混合液则可选用______法;
⑵步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用_____________笔(填“钢”或“铅”);
⑶步骤Ⅳ中喷洒Na2CO3溶液后,能观察到的现象是__________________________,这说明实验中________在滤纸上移动速率更快(填“甲基橙”或“酚酞”);
⑷他们可以通过_____________________________来判断分离的效果。
答案..(B)⑴(纸上)层析法(或色层法或色谱法) 渗析 ⑵铅 ⑶内部为黄环,外部为红环 酚酞 ⑷色斑间的距离大小
13.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:
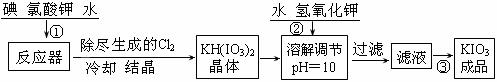
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
答案.
[问题1](1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑;(2)蒸发结晶;
[问题2](1)分液漏斗(多写烧杯、玻璃棒等合理答案不扣分);(2)1270/3w(423.33/w)。
(3)①4I-+4H++O2=2I2+2H2O;②学生乙的实验结果会偏大。
12.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。

① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
答案.(⑴⑵两题每空2分) ⑴太阳能等;
⑵ ① SO2+Br2+2H2O=4H++2Br-+SO42-; 蒸馏(多写萃取不扣分);
② 苦卤样品的体积、Mg(OH)2沉淀的质量;
③ 97.7 mol。 (此小题4分,根据计算过程,酌情给分。)
说明:本试卷中其他合理答案同样给分
11.(江苏海州高级中学2009届高三化学第三次综合测试)(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
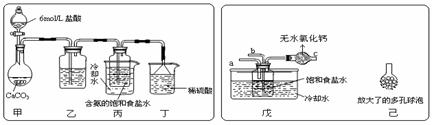 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是
;
(Ⅰ)乙装置中的试剂是
;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入 气体,再从b管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
答案..(1)c (2)①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分);(Ⅲ)过滤 ②(Ⅰ)NH3,CO2 ;(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率;
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等.

10.[江苏省江安中学2009届高三年级第三次月考 ](12分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸氨,再经过再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?



。 (2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A、凯氏烧瓶中溶液转移移到容量瓶中时,未洗涤凯氏烧瓶
B、定容时,俯视刻度线
C、定容时,仰视刻度线
D、移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为
。
已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7
+ 2HCl + 5H2O = 2NH4Cl
+ 4H3BO3
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为
。
答案.
(1)往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞1800,又倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水。
(2)B
(3)10.73%
(4)66.7%
9. [江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](6分)根据下表中序号1提供的探究样例,设计实验探究方案(要求方案尽可能简单)
|
序号 |
探究问题的两种不同猜想 |
设计实验探究方案 |
|
(1) |
向品红溶液中通入一种常见气体后,品红褪色 甲:通入的是氯气。乙:通入的是二氧化硫。 |
实验设计:将褪色后的溶液加热,若红色再现,则通入的是二氧化硫,乙正确。若不再变红,则通入的气体是氯气,甲正确。 |
|
(2) |
在仿有酚酞的氢氧化钠溶液中,滴加新制氯水,边滴边振荡,直到红色刚好褪去。 甲:氯水中的HCl、HClO中和NaOH所致。 乙:氯水中的HClO具有强氧化性使红色酚酞褪色。 |
实验设计:
|
|
(3) |
加热稀氨水,溶液中的C(OH-)的变化。 甲:C(OH-)将增大,升高温度有利于电离平衡移动,使氨水中C(OH-)增大。 乙:C(OH-)将减小。受热时氨易逸出,使氨水中C(OH-)减小。 |
实验设计:
|
|
(4) |
在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。 甲:NH4Cl水解产生的H+与Mg(OH)2电离出来的OH-发生中和反应而使Mg(OH)2溶解。 乙:NH4Cl电离出来的NH4+与Mg(OH)2电离出的OH-结合成弱电解质NH3·H2O,使Mg(OH)2的溶解平衡向右移动,使Mg(OH)2溶解。 |
实验设计:(提示:选择合适的试剂加入到Mg(OH)2悬浊液中) |
答案.(2)向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色复出,则是因为HCl和HClO的酸性所致,甲正确;若红色不再复出,则是因为HClO的强氧化性所致,乙正确。
(3)在试管中注入滴有酚酞的氨水,加热试管,观察溶液颜色变化,如果颜色变浅,则加热使氨水中的c(OH一)减小,乙正确;如颜色变深,则加热使氨水中的c(OH一)增大,甲正确。(或者:分别用pH计测定加热前后溶液的pH值,若加热后溶液的pH值增加,则甲正确;否则,乙正确。)
(4)向Mg(OH)2沉淀中加入中性的醋酸铵浓溶液,加入后若Mg(OH)2不溶解,甲正确;加入后若Mg(OH)2溶解,则乙正确。
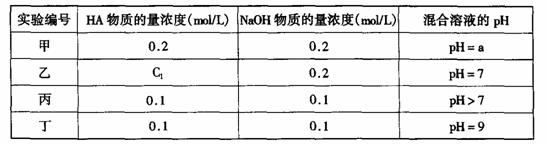
8.[江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A-)= mol/L
答案.
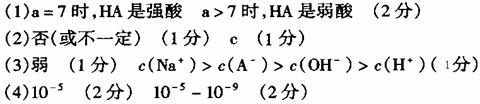

7.[江苏省口岸中学2009届高三年级第二次月考化学试题](10分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
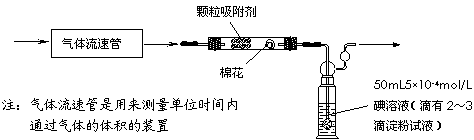
应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
 ⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:_____________________________________________________ __________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
答案..(每空2分,共10分)⑴溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④
6.[江苏省口岸中学2009届高三年级第二次月考化学试题]某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。
5.[江苏省姜堰市姜淮培训中心2009届高三化学周练九](10分)化学是一门以实验为基础的自然科学,
 化学实验在化学学习中具有重要的作用。
化学实验在化学学习中具有重要的作用。
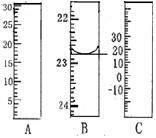
(1) 右图分别是温度计、量筒、滴定管的一部分,
其中A仪器的名称为 ,
B的正确读数为 。
(2)实验室很难配制准确浓度的NaOH溶液,需要
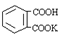 用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
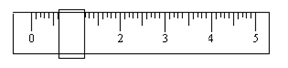 ①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
②将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴 指示剂,当观察到 现象时,可停止滴定,记录数据。
③该学生进行了三次实验,所取固体质量均相同,达到滴定终点时记录所用未知氢氧化钠溶液的体积如下表:
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
22.52 |
|
2 |
22.49 |
|
3 |
22.50 |
则计算氢氧化钠溶液物质的量浓度的表达式为: (用数据表示,不需计算)
④以下操作会造成NaOH溶液浓度偏高的是 (填序号)
A.未用氢氧化钠溶液洗涤碱式滴定管
B.滴定前平视,滴定后俯视读数
C.滴定前滴定管尖嘴有气泡,滴定后气泡消失
D.滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶
答案..(10分)(1)量筒 22.80 (2分)
(2)①,0.6(1分)酚酞(1分)② 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)=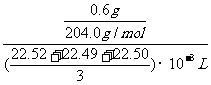 (2分)
(2分)
④B(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com