
12.(江苏海州高级中学2009届高三化学第三次综合测试)某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是[ B ]

A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
11.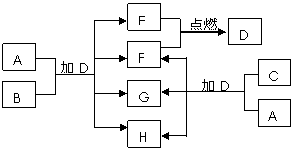 (江苏海州高级中学2009届高三化学第三次综合测试) (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
(江苏海州高级中学2009届高三化学第三次综合测试) (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
(1)写出E+F→D的化学反应方程式:
_________________________________。
(2)B的化学式___ ____,
A的电子式_____ ___。
(3)如上图所示,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为:
______________________________________,________________________________________。
答案..(1)2H2+O2 == 2H2O (2)Al 
(3)2Na2O2+ 2H2O = 4NaOH + O2↑ Al2 O3+ 2NaOH = 2NaAlO2+H2O
9.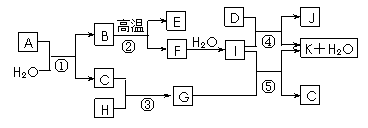 [江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](11分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,C能使湿润的红石蕊试纸变蓝,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
[江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](11分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,C能使湿润的红石蕊试纸变蓝,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的电子式是____________。
(2)反应⑤的化学方程式为___________________________________________。
(3)反应④的化学方程式为___________________________________________
(4)反应③的现象为___________________________________________。
(5)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A化学式为________。
答案..⑴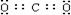 ⑵Ca(OH)2+2NH4Cl
⑵Ca(OH)2+2NH4Cl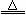 CaCl2+2NH3↑+2H2O
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
CaCl2+2NH3↑+2H2O
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)有白烟产生 (5)CaCN2

10[江苏省江安中学2009届高三年级第三次月考 ] (15分)已知A、B、C是三种常见的固体化合物,焰色反应均显黄色,其中A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。另A、B、C、D之间含有如下的转化关系:(部分物质未写出)

(1)写出物质的化学式:
A 、 B 、 C 。
(2)写出A、B按物质的量之比为1:1在密闭容器中加热发生反应的化学方程式:
。
(3)写出溶质E与足量CO2反应的离子方程式: 。
答案.、(共15分,每空3分)
(1)A、NaOH B、NaHCO3 C、Na2O2
(2)NaOH + NaHCO3 = Na2CO3 + H2O
(3)CO32- + CO2 + H2O =2HCO3
8.[江苏省口岸中学2009届高三年级第二次月考化学试题](10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数
A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
答案..(10分)除最后1个化学方程式3分外,其余每空1分
(1)C<O<N (2)三角锥形 sp3
(3) N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
5.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)
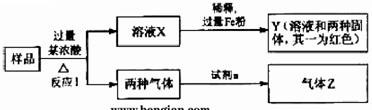
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是____________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是______。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是__________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)__________。
答案.. (1)Al
(2)① C+2H2SO4(浓)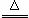 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3

 6.[江苏省姜堰市姜淮培训中心2009届高三化学周练九](10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
6.[江苏省姜堰市姜淮培训中心2009届高三化学周练九](10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
答案.. ⑴Na+[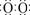 ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
7 [江苏省口岸中学2009届高三年级第二次月考化学试题](15分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物反应:
;
②H2C2与EC2反应:
。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。比元素B原子序数大5的元素基态原子电子排布式是 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以 和 杂化成键,分子中共形成 个σ键, 个π键。
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素的电负性 d .含氧酸的酸性
e .氢化物中X-H键的键长(X代表C和I两元素) f.两单质在自然界的存在
答案..除2个化学方程式各2分外,其余每空1分
(1)B(2)①C+4HNO3==CO2+4NO2+2H2O ②2Na2O2+2CO2==2Na2CO3+O2
(3) PCl3 或CCl4 的电子式(略) 原子 1S22S22P63S23P63d54S1或[Ar] 3d54S1
(4) SP3、SP2 7 1 (5)氮 ce
4、[江苏省姜堰市姜淮培训中心2009届高三化学周练九].根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
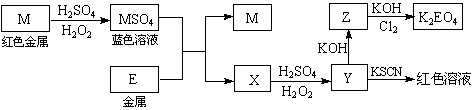
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。

 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: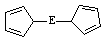 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
答案.. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I- == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
3.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
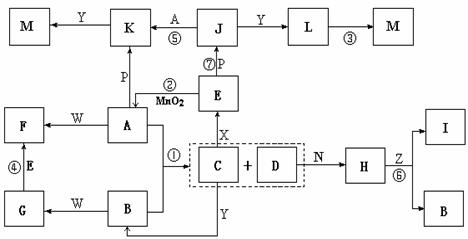
请按要求回答:
⑴写出B的结构式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
答案.⑴ Mg(OH)2 (每空2分)
⑵4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
⑶ Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分)
⑷C为固体,X为浓溶液 无氧(每空1分)
2.[江苏省启东中学2009届高三第一学期第二次月考 ](8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作
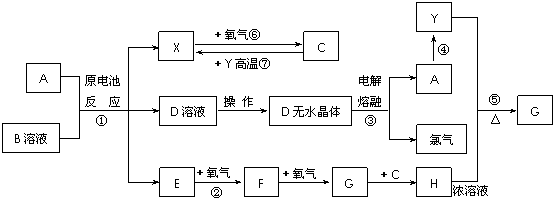 电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
|
|
|
1.[江苏省启东中学2009届高三第一学期第二次月考 ] (10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
答案..(10分) (1)c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)> c(CO32-)
或c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)(2分)
(2)2A13++3SO2-4+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O(2分)
(3)OH-(aq)+H+(aq)=H2O(1);△H=-a KJ/mol
或(a)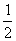 Ba(OH)2(aq)+2HC1(aq)=
Ba(OH)2(aq)+2HC1(aq)=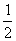 BaC12(aq)+H2O;△H=a
KJ/mol
BaC12(aq)+H2O;△H=a
KJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O;△H=-2a KJ/mol(3分,物质聚集状态、反应热任一方面错都不给分)
(4)0.01mol(3分,无单位只给1分)
15.{江苏省赣榆高级中学09高三年级十二月 }(12分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

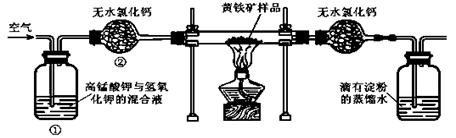
实验时有如下操作:A.将磁管中样品加热到800℃~850℃。 B.称取研细的黄铁矿样品。C.连接好全部仪器,并检查其气密性。 D.将样品小心放入硬质磁管中部。E.以均恒的速度不断鼓入空气。F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤的次序是(以A、B┅的序号表示) 。
(2)装置①的作用是 ;装置②的作用是 。
(3)碘跟SO2水溶液反应的离子方程式为 。
(4)根据 现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点 (填是或否),请说出你的主要理由 。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.0900g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500 mol·L-1,
 则该黄铁矿样品中硫元素的质量分数为 。
则该黄铁矿样品中硫元素的质量分数为 。
 w.w.w.k.s.5.u.
w.w.w.k.s.5.u. c.o.m
c.o.m

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com