
10.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
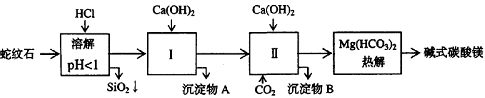
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________。
(2) 进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量, w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
若Ca(OH)2过量可能会导致 溶解、 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(3) 从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________(填写物质化学式)。
(5) 现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③______________________________
④_____________________________ ⑤MgO称量
(6) 18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________、b=_________、c=_________。
答案.、(12分)(1)Fe3+ Al3+;(2)Al(OH) 3、Mg(OH)2;(3)NaOH,过滤、洗涤、灼烧;
(4)CO2;(5)③测出CO2的质量;④测出水蒸汽的质量;(6)3、1、3。
9.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
w.w.w.k.s.5.u. c.o.m
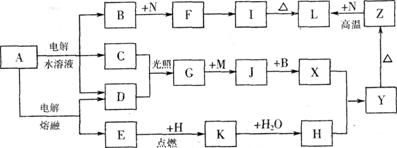
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
答案. (1)阳离子交换膜(2分);
(2)(4分);铝热反应, 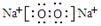
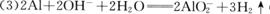 (2分);
(2分);
 (2分);
(2分);
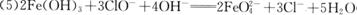 (2分);
(2分);
7.[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]X、Y、Z、W有如右图所示的转化关系,则X、W可能是 [A]
 ①C、O2 ②AlCl3、NaOH
①C、O2 ②AlCl3、NaOH
 ③Fe、HNO3 ④S、O2
③Fe、HNO3 ④S、O2
A.①②③ B.①②
C.③④ D.①②③④
8[江苏省前黄高级中学国际分校09届第一学期期末综合练习二].下述实验能达到预期目的的是 [B]
|
编号 |
实验内容 |
实验目的 |
|
A |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
B |
向硫酸铝溶液中滴加过量氨水 |
制取氢氧化铝 |
|
C |
将氯化铁溶液加热蒸发 |
制氯化铁晶体 |
|
D |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
6、[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]下图表示各物质之间的转化关系。
已知:常温下D、E、F、I、J为气体;C的焰色反应为黄色;M为有颜色的固体。
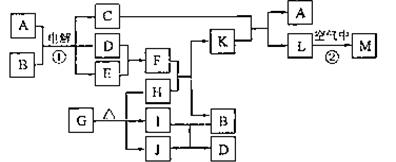
(1)写出:A的电子式 ,J的结构式 ,M的化学式 。
(2)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(3)写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
答案..I
II(10分) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑴ 保护臭氧层
⑵ ① 2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
② CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶ ① H2、Fe3O4
② CO2转化为甲烷的催化剂
③ X(H2)的产量降低,导致反应I中生成的甲酸减少
5、[江苏省前黄高级中学国际分校09届上学期综合练习一]近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式: ▲
② 写出步骤(III)反应的离子方程式: ▲
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
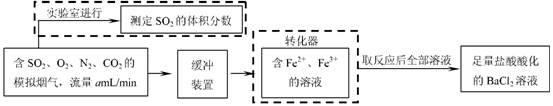 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) ▲ 。

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 ▲
(3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 ▲ 。
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+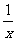 Sx 、
Sx 、
CO+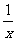 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+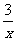 Sx 。其中COS中“C”化合价为
▲ 。
Sx 。其中COS中“C”化合价为
▲ 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 ▲ 。
答案.(方程式2分,其余每格1分)
(1)SO2+NaOH=NaHSO3 HSO3-+H+==SO2+H2O
(2) AB 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量
(3)变废为肥,充分利用资源,降低污染
(4)+4
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O
4、[江苏省前黄高级中学国际分校09届上学期综合练习一] (10分)已知A是由三种元素组成的离子化合物,在一定条件下发生如下图所示的变化(部分转化的反应物、生成物及反应条件已略去),其中L是蓝色沉淀,N是红褐色沉淀,E是一种常见的大气污染物,空气中含量过高时会形成酸雨。常用I的产量来衡量一个国家化学工业发展水平。请回答下列问题:
 ⑴组成E的两种元素位于同一主族,该两种元素气态氢化物的沸点较高的是(填分子式)
⑴组成E的两种元素位于同一主族,该两种元素气态氢化物的沸点较高的是(填分子式)
▲ ;
⑵将E通入G和I的混合溶液所发生的离子方程式为 ▲ ;
⑶写出M→N的化学方程式 ▲ ;
⑷若在J溶液中逐滴加入过量的氨水,实验过程的现象是 ▲ ;
⑸已知A和B充分反应后生成的C、D、E的质量之比是25∶5∶16,则A的化学式为 ▲ 。
答案.
⑴H2O (2)SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
⑶4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷先逐渐产生蓝色沉淀,后沉淀逐渐溶解形成深蓝色的溶液
⑸ Cu5FeS4
w.w.w.k.s.5.u. c.o.m
3.[江苏省前中国际分校2009届高三第一学期第一次调研试卷]茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
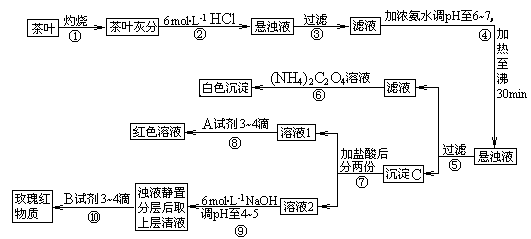
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ____ 。
(2)写出检验Ca2+的离子方程式 ___ 。
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式
(5)步骤⑨的作用是 ,发生反应的离子方程式
(6)猜测步骤⑩的目的是
(7)已知:2Fe + 3/2O2 = Fe2O3,△H = -Q1 kJ/mol; 2Al + 3/2O2 = Al 2O3,△H = -Q2 kJ/mol ,则Q1 Q2(填“>”,“<”或“=”);
答案.(1)使茶叶灰分中的钙、铁、铝等难溶化合物转化成可溶性氯化物 (1)使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解)(2)Ca2++(NH4)2C2O4 = CaC2O4↓+2NH4+
(3)Fe(OH)3、Al(OH)3(共2分,只填一个的给1分)
(4))Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
(5) 使Fe3+转化为Fe(OH)3沉淀,使之与铝元素分离。Fe3++3OH-=Fe(OH)3↓
Al3++3OH-=Al(OH)3↓
(6)检验Al3+(或铝元素)存在。
(7)〈。
2.[江苏省前黄高级中学国际分校09届上学期综合练习三]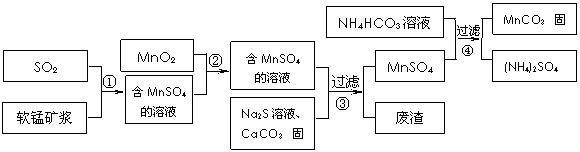 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42-+ 4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
,这样设计的目的和原理是 。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
答案..(1)小(1分),工业制备硫酸(1分)。
(2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O(2分)。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)(1分)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀(2分)。
(4)使MnCO3沉淀完全(2分)。MnCO3沉淀量少,NH4HCO3与酸反应(2分)。
(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(1分)
1.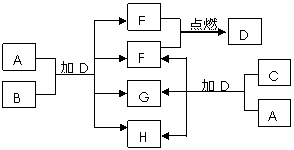 [江苏省前黄高级中学国际分校09届上学期综合练习三] (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
[江苏省前黄高级中学国际分校09届上学期综合练习三] (10分)下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
(1)写出E+F→D的化学反应方程式:
_________________________________。
(2)B的化学式___ ____,
A的电子式_____ ___。
(3)如上图所示,A与C两种固体混合后,加入
液体D,可能发生反应的化学方程式为:
______________________________________,________________________________________。
答案..(1)2H2+O2 == 2H2O (2)Al

(3)2Na2O2+ 2H2O = 4NaOH + O2↑ Al2 O3+ 2NaOH = 2NaAlO2+H2O
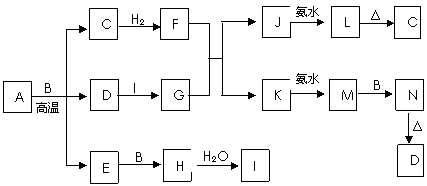
13.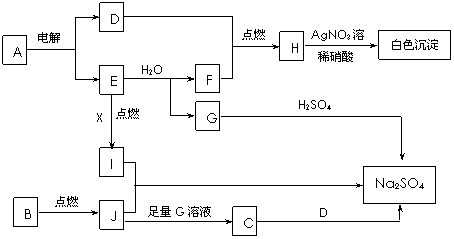 {江苏省赣榆高级中学09高三年级十二月 } (10分)下图中每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,试填空。
{江苏省赣榆高级中学09高三年级十二月 } (10分)下图中每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,试填空。
⑴写出A、B的化学式:A___________,B____________。
⑵写出I和J反应的化学方程式__________________________________________。
写出E和水反应的离子方程式_________________________________________。
⑶写出C溶液和D反应的离子方程式_____________________________________。
答案.. ⑴A:NaCl B:S
⑵Na2O2+SO2=Na2SO4 2Na+2H2O=2Na++2OH-+H2↑
⑶SO32-+Cl2+H2O=2H++SO42-+2Cl-


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com