
22.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是[C]
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
20.(泰兴市第一高级中学2009届高三年级第五次周考)常温下Ca(OH)2溶于水达饱和时存在如下平衡: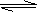 Ca(OH)2(s)
Ca(OH)2(aq),
Ca(OH)2(s)
Ca(OH)2(aq),
Ca(OH)2(aq)==Ca2++2OH- 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为 [A ] ( )
A.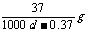 B.
B. C.
C.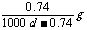 D.
D.
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
19.(江苏省宿迁中学高三实验班化学模拟2)相对分子质量为M的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为ω%,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是
A.相对分子质量M可表示为: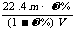 B.物质的量浓度C可表示为:
B.物质的量浓度C可表示为: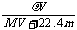
C.溶液的质量分数ω%可表示为: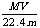 D.溶液密度ρ可表示为:
D.溶液密度ρ可表示为: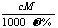
18.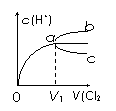 (泰兴市第一高级中学2009届高三年级第五次周考)一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是[BC
]
(泰兴市第一高级中学2009届高三年级第五次周考)一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是[BC
]
A.将饱和氯水加水稀释,溶液中c(H+)变化如曲线b
B.将饱和氯水升高温度,溶液中c(H+)变化如曲线c
C.在饱和氯水中加入NaOH使pH>7,所得溶液中存在
下列关系: c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-)
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在
下列关系: c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
17.(泰兴市第一高级中学2009届高三年级第五次周考)(12分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc (H+),pCl=-lgc(Cl-)]。
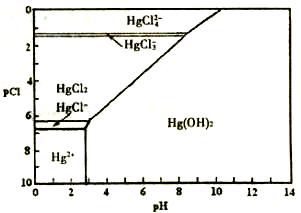 (1)正常海水(Cl-的浓度大于0.1mol/L) 中汞元素的主要存在形态是 ▲ 。
(1)正常海水(Cl-的浓度大于0.1mol/L) 中汞元素的主要存在形态是 ▲ 。
少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元
素的主要存在形态是 ▲ 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 ▲ 。(用离子方程式表示),为了防止出现浑浊,可采取的措施是 ▲ 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为 ▲ 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6X10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= ▲ 。

16.(泰兴市第一高级中学2009届高三年级第五次周考)(6分)硫酸银的溶解度较小,25℃时,每100 g水仅溶解0.836 g。
(1) 25℃时,在烧杯中放入6.24 g硫酸银固体,加200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度。
(2) 若在上述烧杯中加入50 mL 0.0268 mol / L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3) 在(1)题烧杯中需加入多少升0.0268 mol / L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol / L?
答案..(6分)(1) c(Ag+)=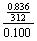 ×2=0.0536 mol
/ L (2分)
×2=0.0536 mol
/ L (2分)
(2) 因为Ag2SO4固体过量,该溶液仍为Ag2SO4饱和溶液,所以c(Ag+)= 0.0536 mol / L (2分)
(3) 设加入的BaCl2溶液的体积为V,
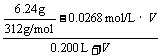 ×2=0.0200 mol / L
×2=0.0200 mol / L
V=0.489 L (2分)
w.w.w.k.s.5.u. c.o.m
15. (常州市第二中学09高三化学期中质量检测试卷)(B)[实验化学]
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.请回答下列问题:
(1).滴定反应达到终点的现象是 .
(2).实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入
(填化学式)试剂可达到这一目的.
(3).在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”).
(4).到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN(填“>”或“<”).
(5).若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 .
答案. (1).溶液由无色变为血红色(2分) (2).酸性 HNO3(各1分)
(3).偏高(2分) (4).> (2分)
(5).0.2mol·L―1 (2分) (6).79.5%(2分)
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
14、(09江苏赣榆海头中学高三化学第二次月考)(10分)如图:横坐标为溶液的pH值,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题。
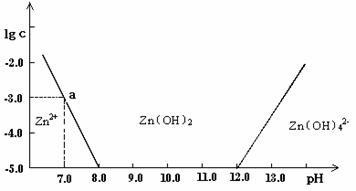
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为
。
(2)从图中数据计算可得Zn(OH)2的溶度积(K sp)= 。
(3)某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 。
(4)往1L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
|
c(HCl)/ (mol·L-1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
103
c(PbCl2)/ (mol·L-1) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是 。
a.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
b.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
c.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
d.PbCl2固体可溶于饱和食盐水
答案.
(1)Zn2++4OH-=[Zn(OH)4]2- (2分
(2)10-17 (2分
(3)(8.0 , 12.0) (2分
(4) 1.8 (2分
13.(江苏省口岸中学09届秋学期高三年级第二次月考)25℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是[ C]
A.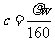 B.
B.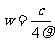 C.
C. D.
D.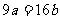
12.(江苏省口岸中学09届秋学期高三年级第二次月考)把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是[AB]
A.加入的NaOH质量一定最大
B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com