
32. [江苏省姜堰市姜淮培训中心2009届高三化学周练九]有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+ 和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是[ AB ]
[江苏省姜堰市姜淮培训中心2009届高三化学周练九]有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+ 和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是[ AB ]
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个
33 [江苏省口岸中学2009届高三年级第二次月考化学试题](15分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物反应:
;
②H2C2与EC2反应:
。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。比元素B原子序数大5的元素基态原子电子排布式是 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以 和 杂化成键,分子中共形成 个σ键, 个π键。
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素的电负性 d .含氧酸的酸性
e .氢化物中X-H键的键长(X代表C和I两元素) f.两单质在自然界的存在
答案..除2个化学方程式各2分外,其余每空1分
(1)B(2)①C+4HNO3==CO2+4NO2+2H2O ②2Na2O2+2CO2==2Na2CO3+O2
(3) PCl3 或CCl4 的电子式(略) 原子 1S22S22P63S23P63d54S1或[Ar] 3d54S1
(4) SP3、SP2 7 1 (5)氮 ce
31.[ 连云港新海高级中学09届高三化学九月质量检查试题]下列变化过程中无化学键断裂或生成的是
A.石墨转化为金刚石 B.NaCl晶体溶于水
C.干冰升华 D.氮的固定
30.[江苏省赣榆高级中学2009年高考双周模拟试卷 ]下列叙述不正确的是[D ]
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
29、[江苏省启东中学2009届高三第一学期第二次月考 ]下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
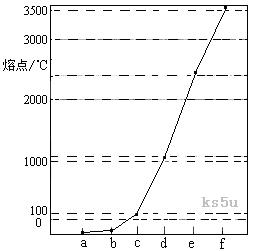
(1)请写出上图中d单质对应元素原子的电子排布式 。
 (2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个 键和 个
键和 个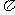 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
(4)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因 。
答案.(1)1s22s22p6 3s2 3p63d104s1(2分) (2)3 2 (各2分)
(3)三角锥形(1分);[Ag(NH3)2]+(1分),配位(2分)
(4)HNO3是极性分子,易溶于极性的水中(1分);HNO3分子中的-OH易与水分子之间形成氢键(1分)

28.[江苏省南通市2009届高三期中检测11月]下列物质固态时熔点的比较正确的是[B ]
A.F2>C12>Br2 B.金刚石>NaCl>02
C.S>NaBr>金刚石 D.Na>CH4>冰
27.[江苏省南通市2009届高三期中检测11月]据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60印结构。下列叙述不正确的是[ AC]
A.该物质有很高的熔点、很大的硬度 B.该物质形成的晶体属分子晶体
C.该物质分子中Si60被包裹在C60里面 D.该物质的相对分子质量为2400
16.[江苏省南通市2009届高三期中检测11月]下列化学式对应的结构式从成键情况看不合理的是 [ D]

25.[江苏省南通市2009届高三期中检测11月]C1S03H称为氯磺酸,是一种强酸。对于反应:ClS03H+HCOOH=CO+HCl+H2S04有如下判断,其中较合理的是 [ BC]
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
24.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]部分中学化学常见元素原子结构及性质如表所示:
|
序 号 |
元素 |
结构及性质 |
|
① |
A |
A是生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
|
② |
B |
B原子最外层电子数是内层电子数的1/5 |
|
③ |
C |
C单质分子中含化学键数最多,单质稳定,但其原子较活泼 |
|
④ |
D |
D被誉为“信息革命的催化剂”,常用的半导体材料 |
|
⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D都能与E化合 |
|
⑥ |
F |
F在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族 |
(1)如果A与冷的浓硝酸作用发生钝化,工业上冶炼A单质的化学方程式为
____________________________________________
(2)A的氯化物的浓溶液分别滴入冷水、热水中,得到黄色和红褐色液体,区别两种液体的方法是________________________________________________________
(3)B与C简单离子的半径大小为_________________(用离子符号表示)
(4) C和D形成的化合物的熔点很高,是一种无机非金属材料,其晶体类型为_____________
(5) F与E可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为:___________________________________________,F与C组成的两种化合物M、N,所含电子数分别与X、Y相等,请写出M的电子式___________,N的化学式___________.
(6)在上述六种元素中,选两种元素组成化合物甲,甲既含有离子键又含有共价键,甲的化学式为___________
答案.(1)(2分)Fe2O3 + 3CO 3CO2 + 2Fe
|
(3) (1分)Mg2+<N3-
(4) (1分)原子晶体
(5) (2分)分别加入MnO2有大量气泡产生的为H2O2 , N2H4
(6) (1分)NH4H
23.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]下列叙述中错误的是
A.能跟酸反应的氧化物,不一定是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109°28′
C.有新单质生成的化学反应不一定都是氧化-还原反应
D.原子晶体中一定含有共价键,离子晶体一定含有离子键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com