
15.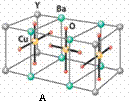 (2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
(2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为______________________________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于___________晶体,N3-的空间构型是_____,与N3-互为等电子体的分子的化学式为___________(写1种)。NH2-的电子式为___________,其中心原子的杂化类型是___________。
(4)CuCl2-中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为_________________。
14.请完成下列各题:
(1)氢负离子H-基态的电子排布式是_____。
(2)下列变化:H-(g)=H(g)+e-吸收的能量为73 kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311 kJ·mol-1l,则氢负电子H-的第一电离能为_____________________。
(3)氢原子能与许多元素化合形成化合物。右图中“·”代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键。如H2O表示为: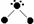
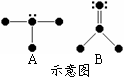 ① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
② C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是________(填A、C、D),原因是_______________________________________________。
(1)1s2;(2)73 kJ·mol-1;(3)①根据判断分子结构的理论可以判断出A为三角锥形,中以原子采用sp3杂化,B为平面三角形,中心原子采用sp2杂化。 ②A的沸点最高,A中存在氢键,C、D中不存在氢键。
13.(2008南京一模)(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式),该物质在CCl4中的溶解度比在水中的溶解度_______ (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g(25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
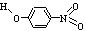 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgO___________NaCl,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4 C.SiF4>NaF>NaCl>NaBr
(1)Na 1s22s22p63s1 HF 小 (各1分);(2)B
2分 ;(3)> > 各2分
;(4)B (2分) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
12.(2008南通一模)氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。w.w.w.k.s.5.u. c.o.m
 请回答下列问题:
请回答下列问题:
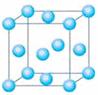
⑴写出铬原子的基态电子排布式_________________________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为________。
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是______________。
(1)1s22s22p63s23p63d54s1 K、Cu 4;(2)非极性;(3)①③ 直线形
11.(2007·天津)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为____________;XW的电子式为_____________;Z元素在周期表中的位置是_____周期______族。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明__________________________________________________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为____________________________________________________________________,由此可知VW和YW2还原性较强的是(写化学式)____________。
(1)N≡N Mg2+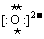 第4周期,第Ⅷ族;(2)① ③;(3)CH4 NH3 NH3+H3O+=NH4++H2O;(4)3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+ SO2
第4周期,第Ⅷ族;(2)① ③;(3)CH4 NH3 NH3+H3O+=NH4++H2O;(4)3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+ SO2
10.写出以下反应的离子方程式:
①[Ag(NH3)2]OH溶液中,加入足量盐酸:__________________________________________________________。
②氢氧化铜溶于氨水:__________________________________________________________。
9.(2007·北京)X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是[D]
A.X的原子半径一定大于Y的原子半径 B.X与Y的简单离子不可能具有相同电子层结构
C.两元素形成的化合物中原子个数比不可能为1︰1 D.X2Y可能是离子化合物,也可能是共价化合物
8.(2007深圳二模)X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是[AC]
A.原子半径的大小顺序:Y>Z>X B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质 D.Y、Z元素的最高价氧化物的水化物不能互相反应
7.(2008年9月南京质检)下列叙述正确的是[AC ]
A.原子晶体中可能存在极性共价键 B.干冰升华时分子内共价键发生断裂
C.原子晶体的熔点比分子晶体的熔点高 D.离子晶体中只含离子键,不含共价键
6.前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种C
A.3种 B.4种 C.5种 D.6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com