
7.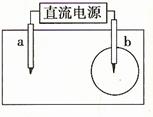 [江苏省前黄高级中学国际分校09姐上学期综合练习三]取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是
[江苏省前黄高级中学国际分校09姐上学期综合练习三]取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是
A.a电极是阴极 B.b电极与电源的正极相连接
C.电解过程中,水是氧化剂 D.a电极附近溶液的pH变小
6.[09届江苏省前黄高级中学国际分校期末化学综合练习四](10分)工业合成氨与制备硝酸一般可连续生产,流程如下:
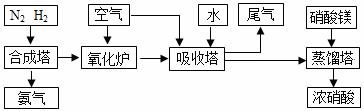
(1)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
 (2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(3)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收
剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2请写出有关反应化学方程式:
, 。
答案.(1) N2+6e-+6H+=2NH3 (2分)
(2) N2 (1分) 生成NO的反应为放热反应,升高温度转化率下降 (2分)
进一步与NO反应生成硝酸(2分)
(3) NO+NO2+H2O=2HNO2;(1分) CO(NH2)2+2HNO2=CO2+2N2+3H2O(2分)
5.[09届江苏省前黄高级中学国际分校期末化学综合练习四]甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是 ( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的PH值逐渐升高,丙中溶液的PH值逐渐减小
4. [ 江苏省泗阳致远中学2009届高三化学综合模拟试卷二]肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃
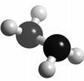 电池。已知肼的球棍模型如右图所示,下列有关说法正确的是
电池。已知肼的球棍模型如右图所示,下列有关说法正确的是
A.肼是由极性键和非极性键构成的非极性分子
B.肼沸点高达l13℃,可推测肼分子间可形成氢键
C.肼燃烧的热化学方程式为: N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH-
3.[江苏省泗阳中学2009届高三第一次摸底考试](10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
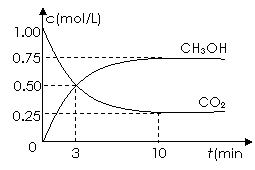
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
答案. ⑴①0.225 ② ③C、D
⑵ 2CO2+4e―+2H2O=2 CO+4OH―
不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行 (每空2分,共10分)
2.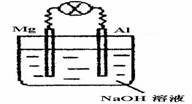 [江苏省泗阳中学2009届高三第一次摸底考试]将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
[江苏省泗阳中学2009届高三第一次摸底考试]将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即
有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向
移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
1.[江苏省泗阳中学2009届高三第一次摸底考试]下列反应的离子方程式中正确的是
A.碳酸氢钠的水解反应:HCO3-+H2O=CO32-+ H3O+
B.在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-= BaSO4↓+H2O
C.以铜作电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.用侯氏制碱法制得NaHCO3 :Na++NH3+CO2+H2O = NaHCO3↓+NH4+
2.[江苏省射阳中学2009届高三第二次月] (14分)
(1)右图折线c可以表达出某一主族元素氢化物的沸点的变化规律,C线上任一物质其VSEPR模型和分子空间构型 。(填“相同”或“不同”)两位同学对某另一主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是: (填“a”或“b”);
(2)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(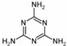 )。下列关于三聚氰胺分子的说法中正确的是
。
)。下列关于三聚氰胺分子的说法中正确的是
。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
(4)I.某种钾的氧化物(氧化钾、过氧化钾或超氧化钾中的一种)的晶胞如图所示(每个黑点或白空点都表示一个阴、阳离子)。则该氧化物的化学式为 。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m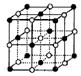
如果将1 mol该晶胞完全转化变成相应的气态离子需吸收的能量为b kJ,则该晶体的晶格能为 。
Ⅱ.如果将上图中的白点去掉并将黑球换成相应的分子或原子,可以得到干冰或
铜的晶胞,它们的配位数均为 。
1.[江苏省射阳中学2009届高三第二次月]下列说法中正确的是:①所有基态原子的核外电子排布都遵循构造原理 ②同一周期从左到右,元素的第一电离能、电负性都是越来越大 ③所有的化学键和氢键都具有相同的特征:方向性和饱和性 ④所有的配合物都存在配位键,所有含配位键的化合物都是配合物 ⑤所有含极性键的分子都是极性分子 ⑥所有离子晶体中都含有离子键 ⑦所有的金属晶体熔点肯定高于分子晶体[B]
A.①② B.⑥ C.③④⑤ D.①②⑥
22.(A)(每个1分,共10分)(1)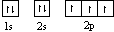 ;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可),
;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可),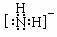 sp3;(4)配位键(写共价键也可) YBa2Cu3O7;(5)
sp3;(4)配位键(写共价键也可) YBa2Cu3O7;(5)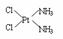
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com