
2.[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]多硫化钠Na2Sx(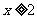 )在结构上与Na2O2,
)在结构上与Na2O2,
FeS2等有相似之处,Na2Sx在碱性溶液中可
被NaClO氧化成Na2SO4,而NaClO被还原
成NaCl,反应中Na2Sx与NaClO的量之比为
1:16,则x值是[A] ( )
A.5 B.4
C.3 D.2
1、[江苏省前黄高级中学国际分校09届上学期综合练习一]近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式: ▲
② 写出步骤(III)反应的离子方程式: ▲
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
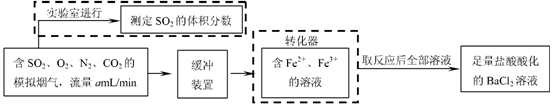
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) ▲ 。
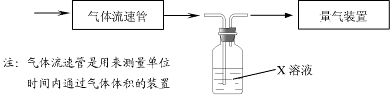
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 ▲
(3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 ▲ 。
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+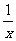 Sx 、
Sx 、
CO+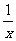 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+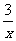 Sx 。其中COS中“C”化合价为
▲ 。
Sx 。其中COS中“C”化合价为
▲ 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 ▲ 。
答案.、(方程式2分,其余每格1分)
(1)SO2+NaOH=NaHSO3 HSO3-+H+==SO2+H2O
(2) AB 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量
(3)变废为肥,充分利用资源,降低污染
(4)+4
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O
2.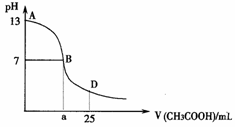 [江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](14分)I .右图为向25mL 0.1
mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](14分)I .右图为向25mL 0.1
mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
|
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系
是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知
a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。(1分)
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(2分)
1.[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ]盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
23.[江苏省江安中学2009届高三年级第三次月考 ]用惰性电极实现电解,下列说法正确的是[ D ]
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m

22、[江苏省江安中学2009届高三年级第三次月考 ]有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量 242g/mol。取1.21g此晶体溶于水,配制成100mL溶液。将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32g。
(1)x值是多少?
(2)求M的相对原子质量和n值。
(3)如电解过程中溶液体积不变,计算电解结束后溶液的PH。
答案.(1)x=2 (2分)
(2)64 (1分) n=3 (1分)
(3)pH=1 (3分)
21.[江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](10分)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色 B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生 D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:Kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?(折算成标准状况,假设该燃料电池的能量利用率为90%)
答案.(1)2Cl-+2H2O═2OH-+Cl2↑+H2↑。(2分)
(2)A(2分)
(3)n(H2)=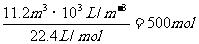
n(已电解NaCl)=500 mol´2=1000 mol(1分)
n(总NaCl)=1000 /0.9 mol m(总NaCl)= 1000 /0.9 mol´58.5g/mol=65000 g(1分)
m(NaCl溶液)=65000 g´136/36´10-3=245.6 kg(1分)
(4)由n(H2)=500 mol得:n(CH4)= 500 mol´2/8/0.9=138.89 mol(2分)
V(CH4)= 138.89mol ´22.4L/mol´10-3m3/L=3.1m3(1分)
20.[江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试](10分)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色 B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生 D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:Kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?(折算成标准状况,假设该燃料电池的能量利用率为90%) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
答案.(1)2Cl-+2H2O═2OH-+Cl2↑+H2↑。(2分)
(2)A(2分)
(3)n(H2)=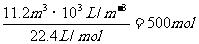
n(已电解NaCl)=500 mol´2=1000 mol(1分)
n(总NaCl)=1000 /0.9 mol m(总NaCl)= 1000 /0.9 mol´58.5g/mol=65000 g(1分)
m(NaCl溶液)=65000 g´136/36´10-3=245.6 kg(1分)
(4)由n(H2)=500 mol得:n(CH4)= 500 mol´2/8/0.9=138.89 mol(2分)
V(CH4)= 138.89mol ´22.4L/mol´10-3m3/L=3.1m3(1分)
19.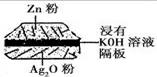 [江苏省赣榆高级中学2009年高考双周模拟试卷 ]如图:一种微型钮扣电池,
[江苏省赣榆高级中学2009年高考双周模拟试卷 ]如图:一种微型钮扣电池,
其电极材料分别为Ag2O和Zn,电解质溶液是KOH 溶液。
该电池负极的反应式: Zn一2e-+2OH-==ZnO+H2O,
总反应式为:Zn+Ag2O==ZnO+2Ag。
根据以上提供的资料,判断下列说法正确的是[A]
A.正极的反应式:Ag2O+2e-+H2O==2Ag+2OH-
B.放电时负极附近溶液的pH不变
C.放电时每消耗6.5g Zn,转移电子0.1mol
D.放电时溶液中阴离子向正极方向移动,阳离子向负极方向移动
18、 [江苏省启东中学2009届高三第一学期第二次月考 ]一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
[江苏省启东中学2009届高三第一学期第二次月考 ]一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-  2CO32-
+6H2O,则有关说法正确的是[ B ]
2CO32-
+6H2O,则有关说法正确的是[ B ]
A . 放电时CH3OH参与反应的电极为正极
B . 放电时负极的电极反应为CH3OH +8 OH- - 6e- = CO32- + 6H2O
C . 标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D . 放电一段时间后,通入氧气的电极附近溶液的pH降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com