
12.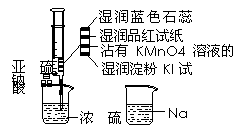 (江苏省奔牛高级中学2008-2009学年度高三第二次调研)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是[CD ]
(江苏省奔牛高级中学2008-2009学年度高三第二次调研)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是[CD ]
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明
SO2 的漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
11.(江苏省栟茶09高三化学测试卷11月)研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是[AD]
A.铜与浓硫酸反应所得白色固体是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中含元素Cu、S
10.(江苏海州高级中学2009届高三化学第三次综合测试)把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的是( AD )
A.气体Y是SO2和H2的混合物 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
9. [江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试] (11分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验 (实验时压强为10lkPa,温度为0℃)。
[江苏省口岸中学2008-2009学年度高三年级第一学期第四次调研测试] (11分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验 (实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4 反应,为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液的体积V≥_______mL,量气管的适宜规格是__________ ___mL。
(选填:200,400,500)。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则发生反立的化学方程式为:__________________ _____。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是 ___________________________________ ________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)
=_____________ __(用含字母的代数式表示)。
答案.(1)20,500 (2)Zn+2H2SO4=ZnSO4+SO2↑+2H2O
(3)得失电子守恒 (4)(64CV-2m)/m(前三空每题2分,后一空每题3分。) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
8.[江苏省口岸中学2009届高三年级第二次月考化学试题](10分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
 ⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:_____________________________________________________ __________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
答案.⑴溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④
7.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]常温下,向20升真空容器中通入a摩尔H2S和b摩尔Cl2(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最大密度是[ B ]
A.19.45克/升 B.18.25克/升
C.17.85克/升 D.35.5克/升
22.(6)(2分)4cVa / (22.4cVa + Vb)
(7)(1分)在溶液中I2将SO2氧化的同时,原空气中的O2也能将SO2氧化而被吸收。
5.[ 连云港新海高级中学09届高三化学九月质量检查试题](10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:w.w.w.k.s.5.u. c.o.m
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
程式:
 A12Te3 + ( ) A1(OH)3↓ + H2Te↑
A12Te3 + ( ) A1(OH)3↓ + H2Te↑
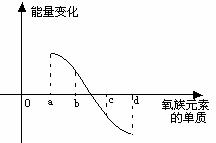
(6)右图所示为氧族元素单质与H2反应过程中的能
量变化示意图,其中a、b、c、d分别表示氧族中某
一元素的单质,△E为相同物质的量的单质与H2反应
过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
答案.(1)113 - 450℃; (1分) (2)-2、+4、+6; (1分)
(3)H2Te>H2Se>H2S; (1分)
(4)还原性 (1分) 2H2Se + O2 == 2H2O + 2Se; (2分)
 (5)A12Te3
+ ( 6H2O) 2A1(OH)3↓
+3H2Te↑ (2分)
(5)A12Te3
+ ( 6H2O) 2A1(OH)3↓
+3H2Te↑ (2分)
(6)硫 (1分) 碲 (1分)
6\[ 连云港新海高级中学09届高三化学九月质量检查试题](10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案: w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生, 说明 。
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
__________________________________________________________________________________________________________________________________________________________________________
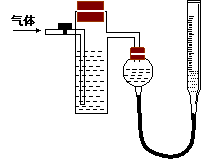 方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的
(填代号)代替: w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol·L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是 。
答案..(10分)(1)(1分)使生成的SO42-完全转化为沉淀
(2)(2分)所加入的BaCl2溶液过量,SO42-完全转化为沉淀
(3)(2分)取最后滤出的洗液少量于一试管中,滴入AgNO3溶液。若溶液变浑浊,则可溶性物质还未除尽;若溶液仍澄清,则可溶性物质已除尽。(操作、试剂各1分,现象和结论1分)w.w.w.k.s.5.u. c.o.m
(4)(1分)偏低,(5)(1分)B (多选或错选都不得分)
4.[ 连云港新海高级中学09届高三化学九月质量检查试题]硫酸铜遇到黄铁矿(FeS2)可以发生反应: 14CuSO4 + 5FeS2 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4 ,在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为:
A. 7:3 B. 3:7 C. 7:5 D. 5:7
3.[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]将KCl和 BaCl2的混合溶液a L均匀分成两份。向其中一份中滴加稀硫酸,使Ba2+离子完全沉淀;向另一份中滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。下列有关推断正确的是[B] w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.x=y
B.c(K+)=(2y-4x)/a mol·L-1
C.若a L混合溶液中c(Cl-)=1mol/L,则y=a、x=0.5a
D.若a L混合溶液中c(K+)=1mol/L,且y=0.4mol,则x=(0.2-0.5a )mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com